
C’est l’un des chiffres les plus symboliques de la « 6ème extinction » qui frapperait actuellement la biodiversité : les populations des insectes volants ont diminué de 75% pendant les dernières décennies en Allemagne. Ce constat alarmant a été formulé une première fois en 2017, par une première publication qui portait sur un nombre relativement faible de sites, suivis entre 1989 et 2016. Fin 2019, un article publié par la prestigieuse revue Nature, sur une période plus courte, mais à beaucoup plus grande échelle, a retrouvé le même ordre de grandeur.
Ces publications scientifiques ont été beaucoup commentées par la presse lors de leur publication. Depuis, elles sont depuis régulièrement invoquées, pour justifier une réduction drastique de l’usage des pesticides (1). En deux ans, ces deux publications ont donc généré un consensus scientifique et politique. Cela alors que les publications précédentes sur ce thème observaient certes des diminutions importantes des populations d’insectes, mais beaucoup moins dramatiques. Comment ces chiffres alarmants ont-ils été calculés, quelle est la part de responsabilité de l’agriculture dans ce déclin ? Essayons pour une fois d’aller au-delà des résumés de ces publications…
Une première publication qui demandait confirmation
Nous passerons rapidement sur la 1ère publication (Hallmann et al, 2017 (2)), dont nous avons déjà analysé les graves faiblesses méthodologiques dans un article précédent (3). Pour résumer l’essentiel :
- Il ne s’agit pas d’un suivi de long terme sur des sites déterminés, mais d’une compilation de résultats disparates, obtenus sur 63 sites différents, dont 26 seulement ont été suivis 2 années ou plus (et aucun plus de 4 fois) !
- Les résultats sont fortement affectés par la répartition très inégale des années de mesure, et en particulier par le fait que les mesures tardives ont pour la plupart été réalisées en 2014, année au climat très défavorable. De plus, les pesées d’insectes, mesurées en poids frais alors que des mesures de poids sec sont plus fiables, semblent avoir été affectées par un changement de protocole de suivi de pièges survenu en 2007 :

Extrait de la Fig. 4a de Hallmann et al 2017 (biomasse moyenne d’insectes capturés quotidiennement). Nous avons retiré la droite de régression pour faciliter la lecture des données. Les couleurs ne sont pas celles du graphe initial. Nous avons mis ici en bleu les années 1989 à 2006 (délai moyen entre relevés des pièges : 1 semaine) ; en orange : années 2007 à 2016 ( délai moyen entre relevés des pièges : 2 semaines). Ces délais moyens de relevés (non indiqués explicitement dans l’article) ont été calculés à partir des données du supplément en ligne S1
Quand on retire du graphique la droite de régression, qui influence inévitablement le lecteur, on constate facilement qu’il n’y a pas une tendance régulière à la décroissance des populations d’insectes, mais deux périodes successives :
- De 1990 à 2006 (en bleu), les biomasses moyennes piégées oscillent le plus souvent entre 4 et 5g/jour, sans tendance claire
- De 2007 à 2016, les résultats tournent autour de 2 g/jour, là aussi sans aucune tendance
Or ces deux périodes correspondent manifestement à un changement de protocole de suivi, non mentionné par les auteurs, mais qui se détecte facilement à l’examen des données détaillées mises en annexe S1 de l’article : la durée moyenne de séjour des insectes dans le piège est passé d’une à deux semaines entre ces deux périodes, ce qui a très probablement influé fortement sur leur taux de déshydratation… et donc sur leur biomasse fraiche, seule variable considérée dans cet article !
Cette étude a connu un très large écho médiatique, malgré ses faiblesses méthodologiques évidentes. Les esprits les plus sceptiques attendaient une confirmation. Celle-ci est venue fin 2019, avec un article de l’une des revues scientifiques les plus prestigieuses au monde : Nature.
L’étude de Nature : entre données et modèle, il faut choisir !
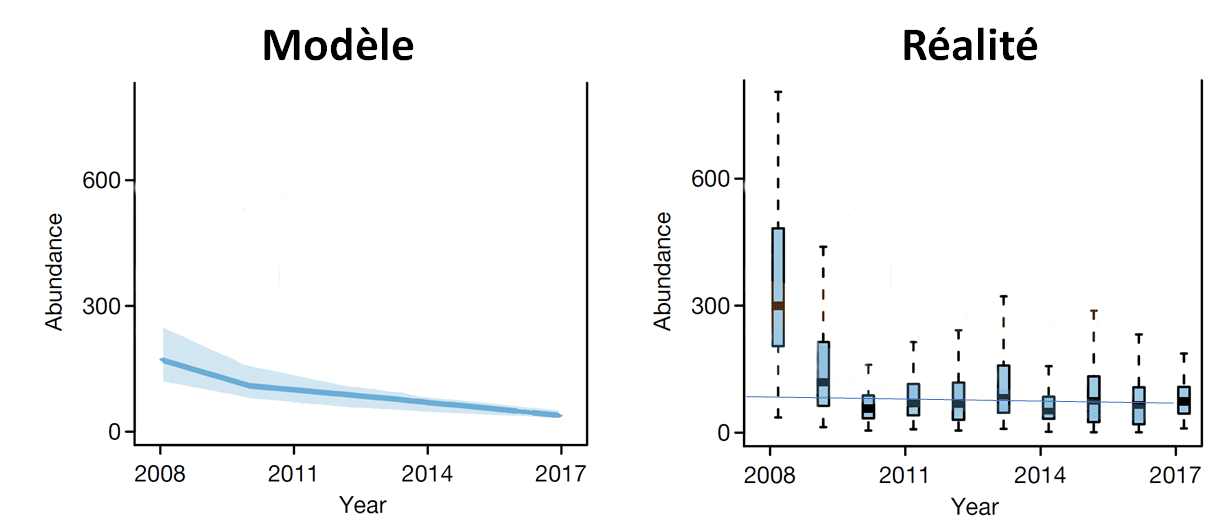
Cette deuxième étude (Seibold et al, 2019) (4) est de bien meilleure qualité selon les critères scientifiques habituels. En effet, elle porte sur un plus grand nombre de sites (150 dans des prairies, et 140 en forêt), et surtout son protocole expérimental est beaucoup plus rigoureux, puisque cette fois les sites ont bien été observés tous les ans. De plus, les auteurs ont comptabilisé le nombre d’espèces observées, leur abondance (nombre d’individus), et leur biomasse, ce qui permet une analyse beaucoup plus riche des résultats. Or cette étude annonce aussi de très fortes baisses de population : dans les prairies, une chute de 67% pour la biomasse, 78% pour l’abondance (nombre d’insectes piégés), et 34% pour le nombre d’espèces. Cette publication a été saluée comme une confirmation de la précédente, mais en fait ses résultats sont encore beaucoup plus alarmants : il s’agit ici du déclin entre 2008 et 2017, soit 10 ans seulement, alors que l’étude de Hallmann et al portait sur une période de 28 ans (1989 à 2016).
Toutefois, un examen attentif des résultats montre des différences sensibles entre les deux études… et surtout que leurs points communs ne vont pas vraiment dans le sens qu’ont cru voir la plupart des observateurs !
Pour Hallmann et al, nous avons vu que les droites de régression superposées aux données avaient une fâcheuse tendance à orienter le regard du lecteur. Malgré la caution hautement scientifique de Nature, nous nous permettrons donc de procéder de même, c’est-à-dire commencer par un petit nettoyage des graphiques, pour ne regarder dans un premier temps que les données elles-mêmes. Prenons l’exemple de l’abondance des arthropodes piégés dans les prairies (les tendances observées sont les mêmes pour la biomasse et le nombre d’espèces) :

1er extrait de la Fig. 1c de Seibold et al 2019 : Abondance des arthropodes piégés dans les prairies en fonction de l’année. Les barres horizontales noires représentent la médiane, les « boîtes » bleues représentent les limites des 25ème et 75ème percentiles (ce qui signifie que 50% des données sont encore plus éloignées de la médiane que les limites de ces boites).
La tendance observée sur les données brutes est encore plus surprenante que celle de Hallmann et al : cette fois, il y aurait eu un effondrement total des populations en seulement 2 ans (de 2008 à 2010), suivi d’une grande stabilité de 2010 à 2017. Cela si on considère les données comme représentatives, car le résultat de 2008, la seule année qui se détache vraiment des autres, est affligée d’un écart-type énorme, qui aurait dû empêcher toute comparaison avec les années suivantes, tant que les raisons de cette anomalie n’ont pas été identifiées. Les auteurs ne donnent pas de résultats d’analyse statistique pour comparer les années entre elles, mais au vu du graphique, il parait évident qu’aucune année n’est significativement différente des autres, sauf peut-être 2008. Et même si l’on suppose que la différence entre 2008 et les autres années est statistiquement significative, il est permis de s’interroger sur sa significativité pratique : comme il s’agissait de la 1ère année de piégeage, on peut supposer que l’énorme écart-type des résultats de cette année était l’effet d’un problème d’homogénéité des mesures sur les différents sites, qui aurait été corrigé par la suite.
Bien sûr, comme nous sommes dans Nature, on ne se contente pas de résultats non significatifs. Si les résultats bruts ne montrent aucune tendance régulière, les auteurs ont tout de même trouvé un modèle qui décèle une tendance significative sur l’ensemble de la période :

2ème extrait de la Fig. 1c de Seibold et al 2019 : Modèle statistique simulant l’abondance des arthropodes piégés dans les prairies en fonction de l’année (ligne bleue), avec intervalle de confiance à 95% (aire bleu clair)
Voilà qui a bien meilleure allure : une belle courbe régulière, qui décroit inexorablement vers le zéro absolu de l’extinction des insectes, avec cette fois un intervalle de confiance très raisonnable, dont la largeur tend même vers zéro à mesure que le temps avance… C’est aussi beau qu’effrayant, mais n’oublions pas quand même que ce modèle a été calculé à partir des données quelque peu suspectes vues à la figure précédente. On aurait donc bien aimé savoir si cette courbe de tendance reste significative, quand on retire l’année 2008… On constate en tout cas qu’elle modifie complètement la perception des résultats : elle transforme la brutale et peu crédible chute de population entre 2008 et 2010, suivie d’un « faux-plat » de 2010 à 2017, en une décroissance régulière tout au long de la décennie.
Bien sûr, il s’agit cette fois d’un modèle multivarié, qui prend en compte le climat et l’occupation du sol aux environs du site de piégeage. Il n’est donc pas forcément aberrant que son comportement puisse différer sensiblement de celui des données brutes, et il peut avoir décelé des tendances qui n’apparaissent pas à l’examen des données brutes. Mais dans ce cas on aurait aimé que les auteurs nous expliquent quelles évolutions de ses variables d’entrée expliquent la régularité de la tendance observée, alors que ces entrées sont des variables climatiques (qui varient fortement et de façon aléatoire d’une année à l’autre) et l’occupation des sols (qui varie beaucoup moins vite, et dont les auteurs reconnaissent d’ailleurs qu’elle n’a pas d’effet très clair sur les populations observées).
En tout cas, si on compare dans le détail les deux études, il est très optimiste de dire qu’elles se confirment mutuellement. Nous l’avons déjà remarqué : elles annoncent certes des réductions de biomasse assez voisines (-76 % pour Hallmann, – 67% pour Seibold)… mais il s’agit de de la baisse sur 28 ans pour la 1ère, et sur 10 ans seulement pour la seconde ! De plus, pour Seibold et al, cette chute de la biomasse vient presque uniquement de la différence entre 2008 (avec des populations d’insectes très abondantes) et l’ensembles des années suivantes (avec des populations beaucoup plus basses). Or, contrairement à ce qu’affirme une remarque de Seibold et al (page 672, bas de la 1ère colonne), on n’observe pas du tout les mêmes tendances chez Hallmann et al, où 2008 est au contraire une année très ordinaire, et ne se distingue en rien des années 2009 à 2016. De même, il y a une forte remontée des populations en 2011 chez Hallmann et al, alors que l’on n’observe rien de tel chez Seibold et al. Mais il est vrai que cette divergence de 2011 n’a aucune signification, puisque cette année-là il n’y avait qu’un site de piégeage chez Hallmann et al : c’est une simple illustration des biais évidents dus à la mauvaise répartition spatiale et temporelle des sites de piégeage dans cet article.
Si on s’en tient aux données, les deux points sur lesquelles les études convergent ne sont donc pas ceux mis en avant par les commentateurs :
- Dans les deux cas, il n’y a aucune tendance claire sur l’ensemble de la période couverte, mais plutôt des ruptures entre deux périodes : 1989-2006 contre 2007-2016 chez Hallmann et al, 2008 seule contre 2009-2017 chez Seibold et al. Dans le 1er cas, cela coïncide malencontreusement avec un changement de fréquence de relevé de pièges ; dans le second cas, on peut aussi soupçonner une amélioration du protocole de piégeage, après la 1ère année marquée par un écart-type des mesures très supérieur à celui des années suivantes.
- Le seul point sur lequel les deux publications se confirment mutuellement est le fait qu’aucune des deux n’a détecté d’évolution significative des populations d’insectes entre 2009 et 2016.
Quel effet de l’agriculture dans ce déclin ?
Même s’il est probable que le déclin annoncé dans ces articles est très surestimé, il reste vrai que toutes les références sérieuses sur ce sujet observent une diminution sensible des populations d’insectes pendant les trois dernières décennies. Il reste donc intéressant d’examiner l’effet que ces publications attribuent à la proximité des parcelles agricoles dans ce déclin.
L’article de Nature annonce dès son titre que le déclin des arthropodes est lié à des facteurs agissant à l’échelle du paysage, mais la publication reste très évasive sur la nature de ces facteurs. Les auteurs indiquent que l’ampleur du déclin n’est pas associée à l’intensification locale de l’usage des sols, mais qu’il est par contre plus élevé sur les sites localisés dans des paysages à forte couverture agricole. Cette constatation reste difficile à expliquer, mais en tout cas ne suggère guère un effet dû aux pesticides, dont on peut supposer a priori qu’il serait plus fort à proximité des parcelles agricoles qu’à plus longue distance.
Les auteurs de Hallmann et al se sont également penchés sur la question des causes environnementales possibles du déclin des insectes. Curieusement, cette partie de l’article n’est pratiquement jamais citée. Il faut dire qu’elle a de quoi surprendre : en effet, d’après le modèle développé par les auteurs, la proximité des parcelles cultivées serait corrélée négativement à la population d’insectes, ce qui en soit n’a rien de surprenant : une parcelle de grandes cultures est par définition un espace où la biodiversité végétale est réduite, ce qui du même coup réduit fortement la biodiversité des insectes, même s’il s’agit d’une parcelle bio, et peut du même coup retentir sur la biodiversité des espaces naturels voisins. Mais l’évolution dans le temps de l’effet des parcelles agricoles est plus inattendue : d’après le modèle statistique, ce serait l’un des rares facteurs dont l’évolution aurait freiné le déclin des insectes (Figure 5 de Hallmann et al )! Si ce modèle est juste, cela démontrerait que la proximité des parcelles agricoles ne peut pas être le moteur essentiel du déclin des insectes. Bien entendu, ce résultat nous parait aussi douteux que le reste de la publication, et nous n’y attacherons pas plus d’importance. Mais il est révélateur que les nombreux commentateurs, qui s’appuient sur cet article pour dénoncer les méfaits de l’agriculture, omettent toujours de citer ce résultat dérangeant.
Où l’on retrouve la « presse scientifique d’opinion »
Dans un article précédent sur l’épidémiologie nutritionnelle (5), nous avions noté la dérive de certaines publications scientifiques, même dans des revues prestigieuses, vers des procédés relevant plutôt de la presse d’opinion politique : dans une situation où les données se prêtent à des interprétations diverses, elles se contentent de montrer que l’opinion professée par les auteurs est compatible avec les faits observés, sans vérifier si d’autres interprétations le sont aussi. Nous sommes clairement dans ce cas pour l’article de Nature :
- Une analyse basée sur les statistiques descriptives montre clairement qu’il n’y a aucune évolution significative entre 2009 et 2017, et suggère que les résultats divergents de 2008 pourraient être dus à un problème d’homogénéisation des mesures entre les sites
- L’analyse basée sur les statistiques explicatives suggère au contraire une décroissance régulière sur l’ensemble de la période.
Or la seconde hypothèse est la seule qui soit mise en avant dans la publication.
Même si c’est moins flagrant dans Hallmann et al, on note que, là-aussi, les résultats des régressions statistiques ont été superposés aux statistiques descriptives des données, ce qui oriente leur lecture, et occulte des anomalies de distribution de ces données. De plus, un changement de protocole susceptible d’affecter les résultats n’a pas été annoncé par les auteurs.
On ne peut pas incriminer les auteurs ni les revues spécifiquement concernées. Il est probable qu’aucun de ces articles n’aurait été accepté tel quel il y a 30 ans, mais entre temps les critères de validité d’une publication scientifique ont largement évolué. Il est inutile de rappeler que Nature fait référence au niveau mondial. L’article Hallmann et al est paru dans la revue en ligne Plos One, moins prestigieuse mais très influente, et n’a soulevé aucune critique ouverte des milieux scientifiques. Au contraire, le Directeur Scientifique de l’INRAE, C. Huyghe, l’a qualifié d’« excellent », dans un article de la revue de l’AFIS (6), association qui se donne pour but « de promouvoir la science et d’en défendre l’intégrité contre ceux qui, à des fins lucratives ou idéologiques, déforment ses résultats, lui attribuent une signification qu’elle n’a pas, ou se servent de son nom pour couvrir des entreprises charlatanesques».
Il y a donc bien eu un changement de paradigme dans l’évaluation des publications et de l’intégrité scientifique, un changement implicite mais largement partagé par la majorité des autorités scientifiques. Le danger est justement dans son caractère implicite, alors que le grand public est resté sur l’idée ancienne qu’une publication scientifique est l’expression d’un fait objectif et indiscutable, ce qui lui confère une autorité particulière quand elle a des implications politiques.
Les risques liés à cette « science d’opinion » ne sont pas encore apparents dans le domaine de l’écologie, faute de controverses : le consensus de la recherche publique sur ces sujets est très fort, et les objections qui peuvent venir de la recherche privée sont facilement écartées au motif de conflits d’intérêt. Mais les ravages commencent à être sensibles dans les domaines où il existe des querelles d’école entre des chercheurs reconnus, comme la médecine. On l’a bien vu à propos des querelles lamentables sur l’efficacité de la chloroquine contre le covid-19. Le Lancet, une des revues médicales les plus réputées, a dû rétracter piteusement un article dont le fond était probablement juste, mais discrédité par des données non intègres et des erreurs factuelles grossières, non détectées par les reviewers (7). Des errements qui au bout du compte ont profité aux partisans de ce médicament, dont le discours ne brillait pourtant pas par la rigueur scientifique… A terme, ces exemples affligeants ne peuvent que discréditer les sciences en général, et conforter le discrédit de toute forme d’expertise scientifique.
Rendez-vous en 2021 !
Contrairement à l’exploitation politique qui en a été faite, aucune de ces publications ne démontre un effet direct des pesticides sur les populations d’insectes. De plus, leurs données brutes ne montrent aucune évolution significative de ces populations depuis 2009 au moins.
Seul le modèle statistique de Nature indique une tendance significative au déclin des insectes sur la décennie passée. A ce jour il n’est pas encore possible de savoir s’il a réellement détecté une tendance que les données brutes ne permettaient pas d’observer, ou s’il s’agit d’un artefact généré par l’hétérogénéité des données en début d’expérimentation. Mais l’avantage des prévisions apocalyptiques, c’est qu’au bout du compte on finit toujours par savoir si elles étaient justifiées ou non. Parfois c’est un peu long à vérifier, comme ce fut le cas pour la prédiction du calendrier Maya : il a fallu attendre décembre 2012, pour constater qu’elle recélait manifestement une erreur de calcul, malgré l’excellence des astrologues mayas. Dans le cas de l’article de Nature, nous serons heureusement fixés plus vite :
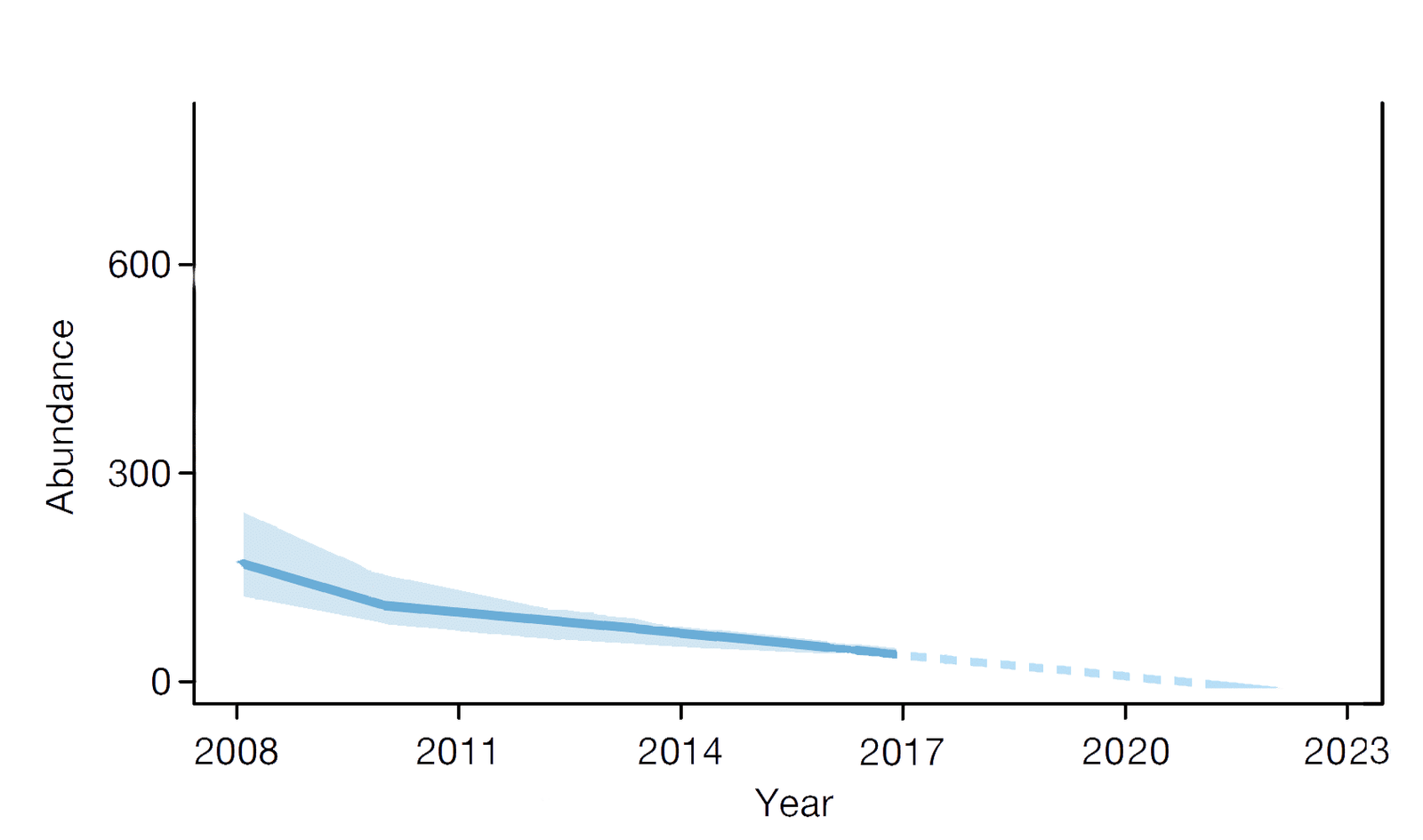
Extrapolation du modèle de Seibold et al. Le trait continu bleu représente le modèle tel qu’il figure dans l’article Fig 1c, la partie en tirets est la prolongation de la tendance 2010-2017.
Si on prolonge la courbe tracée par le modèle, on voit que les insectes auront disparu des prairies allemandes dès 2021. Rendez-vous donc à l’année prochaine, pour savoir s’il valait mieux croire les données ou le modèle statistique !
(2) https://doi.org/10.1371/journal.pone.0185809
(3) https://www.agriculture-environnement.fr/2018/08/23/au-sujet-du-declin-des-insectes-volants
(6) https://www.afis.org/Production-agricole-et-preservation-de-l-environnement-est-ce-possible#ref2
(7) https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31180-6/fulltext
Pas besoin pourtant d’être scientifisue pour constater que l’été, sur le parebrise des voitures on a plus d’insectes écrasés qui gènent la visibilité. Alors qu’il y a seulement 40 ans, on ne pouvait pas rouler sans nettoyer le parebrise tellement il y en avait!
Il semblerait que la. disparition des insectes soit dû aux champs magnétiques générés par l’électricité et les ondes des antennes-relais de la téléphonie mobile.
L’arc-en-ciel invisible
Unehistoiredel’électricitéetdelaVie
Résuméinformatif
par
SosthèneBerger,Dipl-Ing
Résumésubséquentàlalecturede:
TheInvisibleRainbow
AHistoryofElectricityandLife
by
ArthurFirstenberg
Bien sûr, personne ne conteste que les populations d’insectes ont baissé depuis 40 ans, je le rappelle dans l’article. Les questions qui se posent sont de savoir qu’elle est l’ampleur réelle de cette baisse, si elle continuent actuellement (curieusement, les 2 études citées ne voient aucune évolution depuis 2009, et quelles sont ses causes).
Pour cela, il faudrait des données fiables dans le temps. On ne peut pas se contenter d’impressions subjectives comme celles laissées par le nombre d’insectes sur les pare-brise, qui est biaisé par l’évolution de l’aérodynamisme des voitures, l’artificialisation croissante de la végétation des bords des routes, et l’extension de l’éclairage public qui pendant la nuit attire les insectes en hauteur, au-dessus des zones où ils risquent d’être heurtés par les voitures.
En faisant des prédictions absurdes qui seront démenties rapidement, ces publications risquent de retarder la mise en place de recherches sérieuses.
Les « recherches sérieuses » ont déjà été entreprises par Rachel Carson dans les années 1950 et 60, et elle prédisait un Printemps silencieux à l’époque.
Et maintenant que nous y sommes, vous faites du révisionnisme à la petite semaine.
Votre commentaire est typique de ceux auxquels on s’expose quand on essaie de ramener un peu de rigueur dans le débat écologiste : des insultes politiques pour esquiver toute réflexion scientifique.
Le révisionnisme (j’ai eu aussi droit sur un autre site au « négationnisme ») fait partie du vocabulaire politique, et non scientifique. Son seuil lien avec le monde scientifique est qu’il est souvent utilisé pour qualifier la remise en cause du consensus scientifique ou historique, afin de nier des faits indiscutables.
J’ai bien rappelé dans mon article, et dans le commentaire que vous critiquez, que le consensus scientifique est qu’il y a une décroissance sensible des populations et de la biodiversité des insectes en Europe, mais à un rythme de l’ordre de 20 à 30% sur les dernières décennies. Les deux publications que je cite sont les seules qui fassent état d’un effondrement aussi rapide et improbable sur les 10 ou 27 dernières années, ce sont bien elles qui remettent en cause le consensus scientifiques, et pas moi. Les auteurs de ces deux publications le signalent eux-mêmes dans leurs articles. D’autres études plus larges, parues après ces deux articles, maintiennent le consensus actuels, et critiquent ouvertement les excès de ces deux publications :
http://www.sciencemagazinedigital.org/sciencemagazine/24_april_2020_Main/MobilePagedArticle.action?articleId=1580364#articleId1580364
https://science.sciencemag.org/content/368/6489/417
Mon objet dans cet article était de montrer les erreurs méthodologiques évidentes, qui expliquent les chiffres aberrants affichés par ces publications. Si vous avez identifié une erreur de raisonnement dans mon article, n’hésitez pas à me les signaler.
Excusez-moi, j’ai oublié que vous faisiez de « La Science » et pas de politique. C’est-à-dire que vous défendez objectivement toutes les formes de puissances technoscientifiques au service de la domination et de l’exploitation des humains et de la nature. Et que l’émancipation et l’autonomie – concepts politiques – vous sont totalement étrangers. Merci pour ce rappel…
Vous continuez à réagir, non pas à ce que j’écris, mais aux intentions délirantes que vous me prêtez. Il y a une telle incohérence entre mes propos et l’interprétation que vous en faites, que cela en devient comique.
J’écris un article de vulgarisation, pour inciter les lecteurs à ne pas se laisser abuser par les scientifiques qui profitent de la complexité des méthodes statistiques qu’ils utilisent, afin de biaiser le débat politique. Il s’agit donc bien de dénoncer les intrusions injustifiées de la science dans la politique. C’est ma conception de l’émancipation, par rapport aux idéologies qui prétendent à tort s’appuyer sur la science (en l’occurrence les courants écologistes « localistes »), et une invitation à acquérir une culture scientifique suffisante pour exercer son autonomie de jugement sur ces sujets.
Le seul intérêt de votre sortie complotiste sur la « défense objective de toutes les formes de puissances technoscientifiques au service de la domination et de l’exploitation des humains et de la nature », c’est qu’elle illustre bien la façon dont les idéologues dogmatiques de l’écologie décroissante esquivent tout débat sur les faits réels : en prétendant qu’analyser objectivement les données sur l’environnement, c’est forcément défendre une vision technophile du monde.
Une fois encore, vous esquivez toute argumentation factuelle. Je reviens à la question que je vous posais précédemment : voyez-vous quelque chose de faux dans mon article ? Si ce n’est pas le cas, vous devriez quand même vous demander pourquoi vos grandes théories sur l’exploitation des humains et de la nature ont besoin d’arguments scientifiquement faux pour exister. De quoi cherchez- vous à vous émanciper : des « puissances technoscientifiques », ou des éléments du monde réel qui perturbent vos théories ?
Sur la façon dont l’écologie « localiste » (qui surestime les impacts locaux de l’agriculture) finit par nuire aux enjeux globaux de l’environnement (émissions de gaz à effet de serre, déforestation des pays tropicaux), voir :
https://www.linkedin.com/pulse/green-deal-agricole-une-vision-myope-et-pass%25C3%25A9iste-de-l%25C3%25A9cologie-stoop/?trackingId=bK%2BWmGj5Zr0ELaqWUd9kzQ%3D%3D
L’argument du pare brise :
Pas les mêmes technologie de phares cela attire certainement moins les insectes
Pas le même aérodynamisme des voitures des pares brises ….
Pas besoin d’être un scientifique pour le constater. Par contre, une formation scientifique aide à en comprendre les raisons possibles. Le parc automobile français de 1970 à 2010 a augmenté de 13 millions à 37 millions de véhicules (un facteur 2,8). Le nombre de kilomètres moyen parcouru a augmenté de 140 à 424 sur la même période (facteur 3). Soit une fréquence de déplacement de pare-brise d’un facteur 8,4. Ce qui signifie que chaque véhicule avait 8 fois moins de chance de heurter un insecte. De plus, les déplacements dans les années 70 se réalisaient surtout sur des routes nationales qui passaient au milieu des cultures où les insectes trouvaient leur nourriture. Les déplacements en 2010 se réalisaient surtout sur des autoroutes où les insectes ne trouvent rien à manger. Ils ne s’y rendaient donc pas. Enfin, les pare-brises des voitures de 2010 sont plus aérodynamiques et réduisent risques de collisions. Ces trois effets combinés sont largement suffisants pour rendre compte d’une décroissance du nombre d’insectes collés sur les pare-brises.
Il semblerait que la. disparition des insectes soit dû aux champs magnétiques générés par l’électricité et les ondes des antennes-relais de la téléphonie mobile.
L’arc-en-ciel invisible
Unehistoiredel’électricitéetdelaVie
Résuméinformatif
par
SosthèneBerger,Dipl-Ing
Résumésubséquentàlalecturede:
TheInvisibleRainbow
AHistoryofElectricityandLife
by
ArthurFirstenberg
Merci pour votre point de vue, je laisse les lecteurs juges…
Parce que vous pensez que les champs magnétiques anthropogènes sont comparables à l’ordre de grandeur près à ceux déjà émis naturellement par la Terre ?
Si ce n’était pas aussi ridicule et complotiste, ce serait drôle.
Excellent. C’est vrai que la chute de la population de 2008 et 2010 aurait dû interroger les auteurs.
Quant à la question du pourquoi de la baisse du nombre d’insectes, nous pourrions nous livrer à une expérimentation simple à savoir une réouverture des décharges sauvages, des fumières à l’ancienne. J’émets l’hypothèse que nous retrouverions un terreau fertile en insectes.
Pas sûr que ce soit accepté par la population…
La manière de prolonger la courbe de déclin des populations sur la dernière figure (fig. 1c de Seibold et al.) est fausse. Un phénomène de décroissance ne suit jamais une loi linéaire. (Les auteurs ne l’ont d’ailleurs pas prétendu : on voit une inflexion sur la courbe issue de leur modèle.)
Vraisemblablement, il aurait fallu appliquer un modèle de décroissance exponentielle. Dans un tel cas, zéro devient une asymptote. Autrement dit, plus le temps passe, plus on s’approche lentement de zéro.
Donc non, nous ne serons pas définitivement fixé en 2021.
Merci de bien vouloir lire l’article Seibold. Contrairement à ce que vous affirmez, le modèle des auteurs est bien un modèle linéaire. Simplement c’est un modèle mixte linéaire, qui prend en compte non seulement le temps, mais aussi des indicateurs climatiques et l’occupation des sols locale et à grande échelle. C’est ce qui explique qu’il puisse présenter des inflexions comme c’est le cas en 2010, mais dans ce cas ce serait bien que les auteurs nous expliquent quelle évolution des variables d’entrée a provoqué cette inflexion. Or, comme je le signale dans mon article, il n’y a aucune explication sur ce sujet, pourtant crucial pour juger de la crédibilité de leur modèle.
Vous avez raison de dire qu’en théorie, rien n’oblige la courbe du modèle à poursuivre sur la même lancée que pendant la période 2010-2017. Elle peut se stabiliser, voire se mettre à remonter à tout moment. Mais comme cela reste un modèle linéaire, il faudrait un changement très fort des variables d’entrée autres que le temps, pour provoquer un changement significatif de pente. C’est d’autant moins probable que la pente a été parfaitement régulière pendant toute la période (avec en plus un intervalle de confiance qui s’est resserré à un niveau ridiculement bas, digne d’une expérience de physique nucléaire).
Là où vous avez raison, si que si par miracle il y a encore des insectes dans les prairies allemandes l’année prochaine, il reste une petite chance que le modèle soit juste. Mais alors il faudra que les auteurs nous expliquent quel changement cataclysmique du climat ou de l’occupation des sols aura provoqué en 4 ans une inflexion forte, par rapport à une tendance aussi parfaitement linéaire sur 8 ans.
Votre allusion aux exponentielles est également révélatrice. Il est vrai :
– qu’une courbe de décroissance exponentielle serait plus logique d’un point de vue mécaniste, si on suppose que la population d’insecte est exposée à une pression régulière, qui la fera baisser d’un facteur à peu près constant chaque année
– qu’une régression exponentielle conviendrait bien aux données présentées… mais uniquement grâce à l’année 2008!
C’est bien sûr pour cela que les auteurs n’ont pas retenu un modèle exponentiel, qui démontrerait trop crûment la dépendance de leur « tendance significative » aux résultats de l’année 2008. Pour être crédible, un modèle exponentiel doit avoir des paramètres à peu près stables quelle que soit la sous-période considérée. Ici, bon courage pour trouver un modèle exponentiel qui tienne la route sur la période 2009-2017!
En fait, l’objet de mon article est double :
– montrer comment la pratique courante, de ne montrer les données que superposées à une régression ou un modèle de tendance choisi par les auteurs, oriente le regard du lecteur et détourne la réflexion nécessaire sur la crédibilité des données
– donner un bel exemple des absurdités auxquelles peut conduire l’utilisation abusive de modèles mixtes linéaires, très commodes pour trouver des tendances significatives dans n’importe quel nuage de points informe, mais totalement inopérants en termes prédictifs, ou pour la recherche de liens de causalité.
Pour un exemple encore plus ubuesque de l’utilisation de ce genre de modèles, voir la fig S2 dans http://www.forumphyto.fr/2016/09/26/les-nuisances-virtuelles-des-neonicotinoides-episode-2-le-retour-des-abeilles-a-puce/
« Contrairement à l’exploitation politique qui en a été faite, aucune de ces publications ne démontre un effet direct des pesticides sur les populations d’insectes. »
Et donc à quoi servent les insecticides s’ils ne servent pas à exterminer les insectes ?!?
Stoop les conneries !!!
Typique du mec qui a arrêté l’école en 5ème. va t’acheter des neurones ou arrête de bouffer vegan parce que t’es vraiment c*n
Je vois que votre argumentation est de plus en plus raffinée, d’un commentaire à l’autre !
Quand je dis qu’aucune de ces publications (il s’agit bien sûr des deux articles cités dans mon texte) ne démontre un effet un effet direct des pesticides sur les populations d’insectes, je ne fais que résumer la conclusion de leurs modèles statistiques. Là encore, si vous trouvez une erreur factuelle dans cette phrase, montrez-moi l’endroit des ces deux articles qui prouverait le contraire.
Et pour rappel, les insecticides ne servent pas à « exterminer les insectes » en général, mais à limiter la populations d’insectes ravageurs dans les parcelles. Les deux articles cités portent sur les populations d’insectes des zones protégées, des forêts, ou des prairies, qui sont des parcelles cultivées mais recevant très peu de pesticides. Si les pesticides appliqués sur les cultures avaient des effets si catastrophiques sur les milieux naturels voisins, on devrait identifier facilement un effet de la proximité de ces parcelles cultivées sur les milieux naturels qui les jouxtent. Or aucune de ces deux publications ne l’affirme.
Merci à l’auteur pour cet effort de vulgarisation des outils statistiques, même si le combat est loin d’être gagné alors que la plupart des gens ignorent qu’il existe plus d’un type de moyenne ou que corrélation ne vaut pas causalité.
Bonjour,
votre article m’attriste à plusieurs points du vue :
– triste de constater que des « évidences » telles que la diminution des populations d’insectes, évidence que vous ne contestez pas, peuvent in fine (et par devers vous) être remises en cause par une lecture trop rapide ou dévoyée de ce même article…
– triste de constater que les revues les plus prestigieuses ne sont pas forcément les garants de la rigueur scientifique que l’on imaginait,
– triste de constater, à la lecture de certains commentaires, qu’il est vraiment très difficile en France d’avoir un débat posé et constructif. Pourquoi s’enflammer quand on n’est pas d’accord ? On peut défendre ses opinion et même dénoncer celle des autres sans pour autant tout défoncer ! Je suis lassé de ce réflexe récurrent d’attaquer des personnes, non pas sur ce qu’elles ont dit, mais sur ce qu’on croit qu’elles veulent ou ont voulu dire ! En l’occurrence, très clairement, vous ne niez pas le déclin des insectes, vous critiquez simplement la méthode scientifique employée pour tenter de le montrer. Où est le problème ? Si on n’est pas d’accord, on peut critiquer, mais pourquoi le faire en s’enflammant à coup de jugements lapidaires et de procès d’intention quand on peut le faire d’argument à argument ?
– enfin, triste de constater que, bien qu’étant moi-même écolo et de formation scientifique, doté d’un esprit que j’espère le plus critique possible, mais n’ayant ni le temps, ni les compétences de décortiquer chaque article, je reste à la merci d’autrui pour m’aider à y voir clair. Sauf que cet « autrui » semble toujours entaché de doutes, en dépit de sa réputation (Nature…) ou de sa démarche affichée d’intégrité (vous) : ainsi, M. Troop, votre position d’ingénieur agricole cf. votre courte biographie en fin d’article) interroge forcément. Cela a-t-il influencé d’une manière ou d’une autre votre analyse ? Il s’agit d’une vraie question, pas d’une accusation déguisée ni d’une mise en doute sournoise. En vertu de ce sens critique dont je parlais plus haut et, encore une fois, dépourvu du temps et des compétences qui me permettraient de contre-analyser vos propos, je me dois, faute de mieux, de rester prudent et de douter de vous aussi.
Ma seule certitude restera que les insectes et la nature vont mal.
Ce qui est sans doute le plus triste finalement…
Votre attitude a le mérite d’être exprimée courtoisement, mais elle est typique d’une posture assez inquiétante de beaucoup de chercheurs ou scientifiques :
– d’une part, s’interroger systématiquement sur les biais de pensée potentiels des scientifiques du domaine économique. Bien sûr, mon travail dans l’aide à la décision agronomique influence son doute mon point de vue sur ces travaux… tout comme la situation d’un chercheur du public l’incite à privilégier les méthodes d’analyse qui donnent des résultats statistiquement significatifs, et si possible spectaculaires, pour retenir l’attention de revues prestigieuses
– d’autre part, prétendre ne pas avoir les compétences ou le temps pour juger de la pertinence des analyses critiques. Votre commentaire laisse penser que vous avez lu mon article attentivement, vous avez pu donc constater que les méthodes statistiques que je conteste n’ont rien de très sophistiqué. Elles doivent même être très basique pour un écologue comme vous. Qu’est-ce qui vous empêche de juger si mes critiques sont pertinentes ou non? Et, s’il y a des arguments insuffisamment clairs dans mon article, pourquoi ne m’interrogez-vous pas là-dessus, plutôt que sur le rôle que pourrait avoir mon métier d’agronome?
Comme vous le rappelez à la fin, l’important est que la biodiversité diminue en Europe, et qu’il faut en rechercher les causes pour y remédier. Il est sûr que l’agriculture intensive y a son rôle, mais quel est l’effet le plus important, celui de l’uniformisation des paysages et du fractionnement des espaces naturels, ou celui des pesticides? En tant qu’écologue, cela ne vous étonne pas qu’aucun des articles que je cite n’ait pris en compte la surface moyenne des biotopes dans lesquels leurs piégeages ont été effectués? Cela alors qu’un résultat au moins dans l’article de Nature suggère fortement un effet de la relation aire-espèce : le fait que la proximité des parcelles agricoles n’ait pas d’effet négatif significatif (ce qui ne plaide guère en faveur d’un effet de contamination par les pesticides), alors que la proportion d’espace agricoles à l’échelle régionale a un effet négatif sur la biodiversité.
Je vais essayer d’être bref :
– je ne vois pas ce qu’il y a « d’inquiétant » à s’interroger sur les liens entre les chercheurs et leurs recherches. Certains de ces liens – en général financiers – permettant souvent de comprendre, sinon les résultats, du moins la posture « douteuse » (comprendre « partiale ») de chercheurs : cf. les affaires médicales récentes pour citer un exemple hors écologie (Précision : il ne s’agit pas d’une insinuation vous concernant car encore une fois, je ne sais rien de vous).
– je suis d’accord avec vous que je pourrais certainement passer du temps à essayer de comprendre toutes ces stats – même si je suis davantage naturaliste que biostatisticien. Certains verront donc de la paresse à mon inaction. Soit. Mais il y a aussi ce que j’écrivais : je trouve triste qu’il faille tout reprendre par soi-même parce que l’on ne peut plus avoir confiance en des experts, qu’il s’agisse de revues ou de scientifiques, pour les différentes raisons exposées. D’autres y verront donc du pragmatisme : je me fiche de savoir comment on a pu prouver (ou pas) que l’eau du bain était polluée, je me fiche à peine moins de savoir qu’est-ce qui pollue LE PLUS cette eau (les pesticides ? les espèces invasives ? les rejets ?), seule m’intéresse la santé du bébé.
– en conclusion, même s’il s’avérait que vous aviez entièrement raison sur tout (possibilité que je ne nie aucunement), je trouve que votre article contribue à noyer le bébé dans son eau en cristallisant (j’imagine involontairement) toutes les passions autour d’un problème de méthode au détriment d’un problème de fond. D’autant plus que sa lecture et celle de vos commentaires me laisse sur une désagréable incertitude quant à votre position par rapport aux effets des pesticides sur la biodiversité : à les opposer systématiquement à d’autres causes sans rien pondérer ni hiérarchiser, c’est comme si vous cherchiez à en minimiser l’impact négatif en nivelant le tout. Mais il s’agit seulement là d’une impression et je serais ravi de faire erreur !
Sur votre premier point :
– Les scientifiques et les épistémiologistes ont passé deux siècles à mettre au point une méthodologie scientifique, pour définir ce qu’est une affirmation réfutable, c’est-à-dire dont la véracité ne dépend pas des opinions de celui qui l’émet, ainsi des outils statistiques pour mesurer le risque d’erreur associé à une affirmation réfutable (le risque de 1ère espèce). Pour un scientifique, la question de savoir si un chercheur a une posture douteuse ou partiale (et donc de rechercher la cause de cette attitude) ne devrait donc se poser que si ce chercheur a formulé une affirmation réfutable mal étayée scientifiquement, ou s’il profite de son statut de scientifique pour donner de la crédibilité à des affirmations non réfutables. C’est le respect de ces règles qui permet un débat scientifique serein, car elles permettent de distinguer le débat sur les faits objectifs, qui relèvent pleinement de la science, de celui sur les valeurs éthiques ou politiques, qui n’en relèvent pas, et ne doivent pas y être subordonnées.
– Depuis une vingtaine d’années, dans les disciplines scientifiques à forts enjeux politiques, dont l’écologie, cette attitude est de plus en plus remplacée par une approche où l’on s’interroge d’abord sur les motivations du scientifique qui écrit, avant de décider si ses arguments méritent d’être examinés scientifiquement ou non. Cette posture a été initiée par des militants politiques, mais elle est de plus en plus intériorisée par les scientifiques eux-mêmes. C’est cela que je trouve inquiétant, car cette posture recrée de fait une nouvelle subordination en sens inverse, les arguments scientifiques n’étant plus examinés que si les qualités morales du scientifique, ou la justesse politique de la cause qu’il défend, paraissent satisfaisants.
Dans le cas de mon article, j’ai formulé deux affirmations que je considère comme parfaitement réfutables, et facilement vérifiables par toute personne ayant une culture scientifique minimale :
o Les données présentées dans les deux articles que je critique ne montrent aucune évolution significative des populations d’insectes entre 2009 et 2016
o Dans les deux cas, il n’y a pas une tendance régulière à la décroissance des populations, mais une rupture brutale : après 2006 dans Hallmann et al, après 2008 dans Seibold et al. Il en résulte que les taux de décroissance calculés dans ces publications n’ont aucune valeur prédictive.
En refusant de vous prononcer sur mes arguments, et en détaillant longuement toutes les raisons qui vous font douter de mon objectivité, vous vous situez clairement dans cette nouvelle posture. Je comprends bien que cette mouvance (ce que j’appelle la « science d’opinion ») ne vous inquiète pas, puisque c’est la vôtre. Mais il n’en reste pas moins qu’elle n’est pas conforme aux règles d’intégrité scientifique encore officiellement admises.
Vos deux autres points sont un florilège des procédés de la « science d’opinion » pour esquiver le débat scientifique :
– Se déclarer incompétent pour trancher sur le plan scientifique, contre toute vraisemblance (pour trancher sur la véracité de mes affirmations, il suffit de savoir ce qu’est une différence significative sur le plan statistique). Dans votre premier commentaire, vous vous présentez comme « écolo », de formation scientifique ; quand on vous pose une question précise, voilà que vous n’êtes plus que naturaliste ! Ne vous sous-estimez pas 😊. Sur un autre site, un chercheur de l’INRAE, après m’avoir accusé de négationnisme, a également refusé de se prononcer sur mon article, en prétendant qu’il fallait laisser parler les spécialistes de la biodiversité. Il n’y a pourtant aucun besoin d’être un spécialiste, pour juger de la plausibilité des modèles très simples employés dans ces deux articles
– Inverser systématiquement la charge des asymétries d’information :
o Vous dites ne pas pouvoir vous prononcer sur mes avis, faute d’information sur moi, mais vous en savez toujours plus que moi sur vous, puisque contrairement à vous je publie sous mon vrai nom, et que tous mes articles sont accessibles en ligne gratuitement
o Vous prétendez que je cherche à relativiser le rôle des pesticides, sans le hiérarchiser par rapport aux autres causes possibles de disparition des insectes, alors que c’est justement cette absence de hiérarchisation que je déplore. Il est vrai que vous-même ne vous posez pas trop cette question, puisque dans les causes possibles, vous ne citez que la contamination des milieux naturels par des agents externes (pesticides, espèces invasives, ou de mystérieux « rejets »). A ce propos, vous n’avez toujours pas dit si vous trouviez normal qu’aucune de ces publications n’ait pris en compte l’aire des biotopes de piégeage dans ses modèles statistiques, la relation aire-espèces n’existe plus dans votre version de l’écologie ? (où par ailleurs les connaissances biostatistiques semblent devenues facultatives, vive l’écologie moderne !)
– Réduire la question soulevée à une question méthodologique sans importance par rapport à la question de fond, ce qui est une attitude profondément anti-scientifique : c’est justement la méthode employée, qui permet de juger de la valeur des affirmations de fond formulées par un chercheur.
Vous dites regretter que l’on ne puisse plus faire confiance à la science, mais c’est justement le renoncement des citoyens de culture scientifique au véritable esprit critique, qui porte sur l’analyse des faits et non sur celle des opinions, qui en est la cause. Dans mon article, je n’ai fait que soulever des questions méthodologiques extrêmement basiques, qui auraient dû être posées par les reviewers de Plos One et de Nature. En prétendant que mon article ajoute à ce doute citoyen, qui est légitime, vous inversez une fois de plus les responsabilités : ce sont bien les chercheurs militants (ou simplement peu scrupuleux quand il s’agit de faire de l’impact factor), et les revues négligentes qui acceptent leurs articles, qui sont la cause de ce discrédit. Pas ceux qui attirent l’attention sur ces dysfonctionnements de la presse scientifique.
Le 4 mars 2020, une étude critique faisant le point sur la question scientifique intitulée « Interpreting insect declines: seven challenges and a way forward » a été publiée en libre-accès: https://onlinelibrary.wiley.com/doi/10.1111/icad.12408
En janvier 2020 et avril 2020, une étude critique et un commentaire dans une revue scientique furent publiées:
– Is the insect apocalypse upon us? How to find out. https://www.sciencedirect.com/science/article/pii/S0006320719313497
– Nuanced changes in insect abundance. https://science.sciencemag.org/content/368/6489/368
En janvier et février 2020, deux publications relayant des prises de position furent publiées dans Nature et Biological Conservation:
– International scientists formulate a roadmap for insect conservation and recovery. https://www.nature.com/articles/s41559-019-1079-8
– Scientists’ warning to humanity on insect extinctions. https://www.sciencedirect.com/science/article/pii/S0006320719317823
Donc il s’agit effectivement d’une question de recherche très sérieuse et très importante, dont les conclusions sont encore à trouver.
Article intéressant par son originalité. Vous décortiquez un ou deux articles. Puis-je vous demander de m’aider à contestez les quelques articles suivants, mais relatifs seulement aux abeilles (je peux rechercher pour les Insectes. Votre avis m’intéresse avant de mettre ces articles à la poubelle. Merci d’avance pour votre rigueur scientifique acérée.
Alaux C, Brunet J-L, Dussaubat C, Mondet F, Tchamitchan S, Cousin M, Brillard J, Baldy A, Belzunces LP, Le Conte Y. Interactions between Nosema microspores and a neonicotinoid weaken honeybees (Apis mellifera) Environ Microbiol. 2010;12:774–782. doi: 10.1111/j.1462-2920.2009.02123.x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Alburaki M, Boutin S, Mercier P-L, Loubier Y, Chagnon M, Derome N. Neonicotinoid-treated Zea mays seeds indirectly affect honeybee performance and pathogen susceptibility in field trials. PLoS One. 2015;10:e0125790. doi: 10.1371/journal.pone.0125790. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Alburaki M, Cheaib B, Quesnel L, Mercier P-L, Chagnon M, Derome N (2016) Performance of honeybee colonies located in neonicotinoid-treated and untreated cornfields in Quebec. J Appl Entomol 141:112–121
Andersch W, Jeschke P, Thielert W (2010) Combination of methiocarb and one or more compounds selected from thiacloprid, thiamethoxam, acetamiprid, nitenpyram, and dinotefuran; effective animal pests control and for plant seed dressing. Google Patents. United States: Bayer CropScience AG
Anderson JC, Dubetz C, Palace VP. Neonicotinoids in the Canadian aquatic environment: a literature review on current use products with a focus on fate, exposure, and biological effects. Sci Total Environ. 2015;505:409–422. doi: 10.1016/j.scitotenv.2014.09.090. [PubMed] [CrossRef] [Google Scholar]
Anderson TA, Salice CJ, Erickson RA, McMurray ST, Cox SB, Smith LM. Effects of landuse and precipitation on pesticides and water quality in playa lakes of the southern high plains. Chemosphere. 2013;92:84–90. doi: 10.1016/j.chemosphere.2013.02.054. [PubMed] [CrossRef] [Google Scholar]
Anon (2012) Addendum 7 to the draft assessment report; confirmatory data; imidacloprid. European Food Safety Authority, Parma
Arce AN, David TI, Randall EL, Rodrigues AR, Colgan TJ, Wurm Y, Gill RJ (2016) Impact of controlled neonicotinoid exposure on bumblebees in a realistic field setting. J Appl Ecol. doi:10.1111/1365-2664.12792
Arena M, Sgolastra F. A meta-analysis comparing the sensitivity of bees to pesticides. Ecotoxicology. 2014;23:324–334. doi: 10.1007/s10646-014-1190-1. [PubMed] [CrossRef] [Google Scholar]
Aufauvre J, Biron DG, Vidau C, Fontbonne R, Roudel M, Diogon M, Vigues B, Belzunces LP, Delbac F, Blot N. Parasite-insecticide interactions: a case study of Nosema ceranae and fipronil synergy on honeybee. Sci Rep. 2012;2:326. doi: 10.1038/srep00326. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Barbieri RF, Lester PJ, Miller AS, Ryan KG. A neurotoxic pesticide changes the outcome of aggressive interactions between native and invasive ants. Proc R Soc B. 2013;280:20132157. doi: 10.1098/rspb.2013.2157. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Beketov MA, Liess M. Acute and delayed effects of the neonicotinoid insecticide thiacloprid on seven freshwater arthropods. Environ Toxicol Chem. 2008;27:461–470. doi: 10.1897/07-322R.1. [PubMed] [CrossRef] [Google Scholar]
Benton EP, Grant JF, Mueller TC, Webster RJ, Nicholls RJ. Consequences of imidacloprid treatments for hemlock woolly adelgid on stream water quality in the southern Appalachians. For Ecol Manag. 2016;360:152–158. doi: 10.1016/j.foreco.2015.10.028. [CrossRef] [Google Scholar]
Biddinger DJ, Robertson JL, Mullin C, Frazier J, Ashcraft SA, Rajotte EG, Joshi NK, Vaughn M. Comparative toxicities and synergism of apple orchard pesticides to Apis mellifera (L.) and Osmia cornifrons (Radoszkowski) PLoS One. 2013;8:e72587. doi: 10.1371/journal.pone.0072587. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Blacquière T, Smagghe G, van Gestel CAM, Mommaerts V. Neonicotinoids in bees: a review on concentrations, side-effects and risk assessment. Ecotoxicology. 2012;21:973–992. doi: 10.1007/s10646-012-0863-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Bonmatin J-M, Giorio C, Girolami V, et al. Environmental fate and exposure; neonicotinoids and fipronil. Environ Sci Pollut Res. 2015;22:35–67. doi: 10.1007/s11356-014-3332-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Bonmatin J-M, Marchand PA, Cotte JF, Aajoud A, Casabianca H, Goutailler G, Courtiade M. Bees and systemic insecticides (imidacloprid, fipronil) in pollen: subnano uantification by HPLC/MS/MS and GC/MS. In: Del Re AAM, Capri E, Fragoulis TM, editors. Environmental fate and ecological effects of pesticide. Pavia: La Goliardica Pavese; 2007. pp. 827–824. [Google Scholar]
Bonmatin J-M, Moineau I, Charvet R, Colin ME, Fleche C, Bengsch ER. Behaviour of imidacloprid in fields. Toxicity for honey bees. In: Lichtfouse E, Schwarzbauer J, Robert D, editors. Environmental chemistry. Berlin: Springer; 2005. pp. 483–494. [Google Scholar]
Bonmatin, J.M. Neocotinoids : effets on biodiversity and ecosystems. The issue of higly toxic pesticides in the world. In Neocotinoids : is a Total Ban of Sight ? NGO POLLINIS, nov. 2017, Bruxelles, pp. 22-25
Bortolotti, L., Sabatini, A.G., Mutinelli, F., Astuti, M., Lavazza, A., Piro, R., Tesoriero, D., Medrzycki, P., Sgolastra, F. and Porrini, C. (2009) Spring honeybee losses in Italy. Julius-Kühn Archiv. In: Proceedings 10th international symposium ICP-BR bee protection group “Hazards of pesticides to bees”, Bucharest, Romania, 8–10 Oct 2008, vol 423, pp 148–152
Botías C, David A, Hill E, Goulson D. Contamination of wild plants near neonicotinoid seed-treated crops, and implications for non-target insects. Sci Total Environ. 2016;566-567:269–278. doi: 10.1016/j.scitotenv.2016.05.065. [PubMed] [CrossRef] [Google Scholar]
Botías C, David A, Horwood J, Abdul-Sada A, Nicholls E, Hill E, Goulson D. Neonicotinoid residues in wildflowers, a potential route of chronic exposure for bees. Environ Sci Technol. 2015;49:12731–12740. doi: 10.1021/acs.est.5b03459. [PubMed] [CrossRef] [Google Scholar]
Botías, C., David, A., Horwood, J., Abdul-Sada, A., Nicholls, E., Hill, E., Goulson, D. 2015. Neonicotinoid residues in wildflowers, a potential route of chronic exposure for bees. Environmental Sciences & Techonlogy, 49: 12731-12740.
Canadian Council of Ministers of the Environment (CCME) Canadian water quality guidelines: Imidacloprid. Winnipeg: Scientific Supporting Document. Canadian Council of Ministers of the Environment; 2007. [Google Scholar]
Carreck NL, Ratnieks FW. The dose makes the poison: have “field realistic” rates of exposure of bees to neonicotinoid insecticides been overestimated in laboratory studies? J Apic Res. 2014;53:607–614. doi: 10.3896/IBRA.1.53.5.08. [CrossRef] [Google Scholar]
Casida JE, Durkin KA. Neuroactive insecticides: targets, selectivity, resistance and secondary effects. Annu Rev Entomol. 2013;58:99–117. doi: 10.1146/annurev-ento-120811-153645. [PubMed] [CrossRef] [Google Scholar]
Cox C. Insecticide factsheet: imidacloprid. J Pest Reform. 2001;21:15–21. [Google Scholar]
Cresswell JE, Page C, Uygun M, et al. Differential sensitivity of honey bees and bumble bees to a dietary insecticide (imidacloprid) Zoology. 2012;115:365–371. doi: 10.1016/j.zool.2012.05.003. [PubMed] [CrossRef] [Google Scholar]
Cresswell JE, Robert F-XL, Florance H, Smirnoff N. Clearance of ingested neonicotinoid pesticide (imidacloprid) in honey bees (Apis mellifera) and bumblebees (Bombus terrestris) Pest Manag Sci. 2014;70:332–337. doi: 10.1002/ps.3569. [PubMed] [CrossRef] [Google Scholar]
Cresswell JE. A meta-analysis of experiments testing the effects of a neonicotinoid insecticide (imidacloprid) on honey bees. Ecotoxicology. 2011;20:149–157. doi: 10.1007/s10646-010-0566-0. [PubMed] [CrossRef] [Google Scholar]
Cresswell, J.E., desneux, N. & Van Engelsdortp; D. 2012. Dietary traces of neonicotinoid pesticides as a cause o population declines in honey bees: an evaluation by Hill”-‘s epidemiological criteria. Pest Management Science, 68: 819-827.
Cutler GC, Scott-Dupree CD, Sultan M, McFarlane AD, Brewer L. A large-scale field study examining effects of exposure to clothianidin seed-treated canola on honey bee colony health, development, and overwintering success. PeerJ. 2014;2:e652. doi: 10.7717/peerj.652. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Cutler GC, Scott-Dupreee CD. A field study examining the effects of exposure to neonicotinoid seed-treated corn on commercial bumble bee colonies. Ecotoxicology. 2014;23:1755–1763. doi: 10.1007/s10646-014-1340-5. [PubMed] [CrossRef] [Google Scholar]
David A, Botías C, Abdul-Sada A, Nicholls E, Rotheray EL, Hill EM, Goulson D. Widespread contamination of wildflower and bee-collected pollen with complex mixtures of neonicotinoids and fungicides commonly applied to crops. Environ Int. 2016;88:169–178. doi: 10.1016/j.envint.2015.12.011. [PubMed] [CrossRef] [Google Scholar]
de Perre C, Murphy TM, Lydy MJ. Fate and effects of clothianidin in fields using conservation practices. Environ Toxicol Chem. 2015;34:258–265. doi: 10.1002/etc.2800. [PubMed] [CrossRef] [Google Scholar]
Devillers J, Decourtye A, Budzinski H, Pham-Delegue MH, Cluzeau S, Maurin G. Comparative toxicity and hazards of pesticides to APIS and non-APIS bees. A chemometrical study. SAR QSAR Environ Res. 2003;14:389–403. doi: 10.1080/10629360310001623980. [PubMed] [CrossRef] [Google Scholar]
Di Prisco G, Cavaliere V, Annoscia D, Varricchio P, Caprio E, Nazzi F, Gargiulo G, Pennacchio F. Neonicotinoid clothianidin adversely affects insect immunity and promotes replication of a viral pathogen in honey bees. Proc Natl Acad Sci. 2013;110:18466–18471. doi: 10.1073/pnas.1314923110. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Divley GP, Embrey MS, Kamel A, Hawthorne DJ, Pettis JS. Assessment of chronic sublethal effects of imidacloprid on honey bee colony health. PLoS One. 2015;10:e0118748. doi: 10.1371/journal.pone.0118748. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Douglas MR, Rohr JR, Tooker JF. Neonicotinoid insecticide travels through a soil food chain, disrupting biological control of non-target pests and decreasing soya bean yield. J Appl Ecol. 2015;52:250–260. doi: 10.1111/1365-2664.12372. [CrossRef] [Google Scholar]
Douglas MR, Tooker JF. Large-scale deployment of seed treatments has driven rapid increase in use of neonicotinoid insecticides and preemptive pest management in U.S. field crops. Environ Sci Technol. 2015;49:5088–5097. doi: 10.1021/es506141g. [PubMed] [CrossRef] [Google Scholar]
Ellis, C., Park, K., Whitehorn, P., David, A., Goulson, D. The neonicotinoid insecticide thiacloprid impacts upon bumblebee colony development under field conditions
Elston C, Thompson HM, Walters KM. Sublethal effects of thiamethoxam, a neonicotinoid pesticide, and propiconazole, a DMI fungicide, on colony initiation in bumblebee (Bombus terrestris) micro-colonies. Apidologie. 2013;44:563. doi: 10.1007/s13592-013-0206-9. [CrossRef] [Google Scholar]
European Commission (EC) (2004a) Review report for the active substance acetamiprid
European Commission (EC) (2004b) Review report for the active substance thiacloprid
European Commission (EC) (2005) Review report for the active substance clothianidin
European Commission (EC) (2006) Review report for the active substance thiamethoxam
European Food Safety Authority (EFSA) (2008) Conclusion regarding the peer review of the pesticide risk assessment of the active substance imidacloprid. European Food Safety Authority Scientific Report, European Food Safety Authority, Parma
European Food Safety Authority (EFSA) Conclusion on the peer review of the pesticide risk assessment for bees for the active substance clothianidin. Eur Food Saf Authority J. 2013;11:3066. [Google Scholar]
European Food Safety Authority (EFSA) Conclusion on the peer review of the pesticide risk assessment for bees for the active substance thiamethoxam. Eur Food Saf Authority J. 2013;11:3067. [Google Scholar]
European Food Safety Authority (EFSA) Conclusion on the peer review of the pesticide risk assessment for bees for the active substance imidacloprid. Eur Food Saf Authority J. 2013;11:3068. [Google Scholar]
Falcone JF, DeWald LE. Comparisons of arthropod and avian assemblages in insecticide-treated and untreated eastern hemlock (Tsuga canadensis [L.] Carr) stands in great Smoky Mountains National Park, USA. For Ecol Manag. 2010;260:856–863. doi: 10.1016/j.foreco.2010.06.003. [CrossRef] [Google Scholar]
Feltham H, Park K, Goulson D. Field realistic doses of pesticide imidacloprid reduce bumblebee pollen foraging efficiency. Ecotoxicology. 2014;23:317–323. doi: 10.1007/s10646-014-1189-7. [PubMed] [CrossRef] [Google Scholar]
Food and Environment Research Agency (FERA) (2013) Effects of neonicotinoid seed treatments on bumble bee colonies under field conditions. Sand Hutton, York YO41 1LZ http://FERA.co.uk/ccss/documents/defraBumbleBeeReportPS2371V4a.pdf
Forister ML, Cousens B, Harrison JG, et al. Increasing neonicotinoid use and the declining butterfly fauna of lowland California. Biol Lett. 2016;12:20160475. doi: 10.1098/rsbl.2016.0475. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Fossen M (2006) Environmental fate of imidacloprid. Department of Pesticide Regulation, Sacramento, USA
Frewin AJ, Schaafsma AW, Hallett RH. Susceptibility of Aphelinus certus (Hymenoptera: Aphelinidae) to neonicotinoid seed treatments used for soybean pest management. J Econ Entomol. 2014;107:1450–1457. doi: 10.1603/EC13523. [PubMed] [CrossRef] [Google Scholar]
Galvanho JP, Carrera MP, Moreira DDO, Erthal M, Silva CP, Samuels RI. Imidacloprid inhibits behavioral defences of the leaf-cutting ant Acromyrmex subterraneus subterraneus (Hymenoptera: Formicidae) J Insect Behav. 2013;26:1–13. doi: 10.1007/s10905-012-9328-6. [CrossRef] [Google Scholar]
Gibbons D, Morrissey C, Mineau P. A review of the direct and indirect effects of neonicotinoids and fipronil on vertebrate wildlife. Environ Sci Pollut Res. 2015;22:103–118. doi: 10.1007/s11356-014-3180-5. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Gilburn AS, Bunnefeld N, Wilson JM, Botham MS, Brereton TM, Fox R, Goulson D. Are neonicotinoid insecticides driving declines of widespread butterflies? PeerJ. 2015;3:e1402. doi: 10.7717/peerj.1402. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Gill RJ, Raine NE. Chronic impairment of bumblebee natural foraging behaviour induced by sublethal pesticide exposure. Funct Ecol. 2014;28:1459–1471. doi: 10.1111/1365-2435.12292. [CrossRef] [Google Scholar]
Gill RJ, Ramos-Rodriguez O, Raine NE. Combined pesticide exposure severely affects individual- and colony-level traits in bees. Nature. 2012;491:105–108. doi: 10.1038/nature11585. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Girolami V, Marzaro M, Vivan L, Mazzon L, Giorio C, Marton D, Tapparo A. Aerial powdering of bees inside mobile cages and the extent of neonicotinoid cloud surrounding corn drillers. J Appl Entomol. 2013;1-2:35–44. doi: 10.1111/j.1439-0418.2012.01718.x. [CrossRef] [Google Scholar]
Godfray HCJ, Blacquière T, Field LM, et al. A restatement of the natural science evidence base concerning neonicotinoid insecticides and insect pollinators. Proc R Soc B. 2014;281:20140558. doi: 10.1098/rspb.2014.0558. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Godfray HCJ, Blacquière T, Field LM, et al. A restatement of the natural science evidence base concerning neonicotinoid insecticides and insect pollinators. Proc R Soc B. 2015;282:20151821. doi: 10.1098/rspb.2015.1821. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Goulson D, Nicholls E, Botías C, Rotheray EL. Bee declines driven by combined stress from parasites, pesticides and lack of flowers. Science. 2015;347:1255957. doi: 10.1126/science.1255957. [PubMed] [CrossRef] [Google Scholar]
Goulson D. An overview of the environmental risks posed by neonicotinoid insecticides. J Appl Ecol. 2013;50:977–987. doi: 10.1111/1365-2664.12111. [CrossRef] [Google Scholar]
Goulson D. Neonicotinoids impact bumblebee colony fitness in the field; a reanalysis of the UK’s Food & Environment Research Agency 2012 experiment. Peer J. 2015;3:e854. doi: 10.7717/peerj.854. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Goulson D. Pesticides linked to bee declines. Nature. 2014;511:295–296. doi: 10.1038/nature13642. [PubMed] [CrossRef] [Google Scholar]
Graystock P, Goulson D, Hughes WOH. Parasites in bloom: flowers aid dispersal and transmission of pollinator parasites within and between bee species. Proc R Soc B. 2015;282:20151371. doi: 10.1098/rspb.2015.1371. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Gupta S, Gajbhiye VT, Gupta RK. Soil dissipation and leaching behavior of a neonicotinoid insecticide thiamethoxam. Bull Environ Contam Toxicol. 2008;80:431–437. doi: 10.1007/s00128-008-9420-y. [PubMed] [CrossRef] [Google Scholar]
Hallmann CA, Foppen RPB, van Turnhout CAM, de Krooon H, Jongejans E. Declines in insectivorous birds are associated with high neonicotinoid concentrations. Nature. 2014;511:341–344. doi: 10.1038/nature13531. [PubMed] [CrossRef] [Google Scholar]
Heimbach F, Russ A, Schimmer M, Born K (2016) Large-scale monitoring of effects of clothianidin dressed oilseed rape seeds on pollinating insects in Northern Germany: implementation of the monitoring project and its representativeness. Ecotoxicology 25:1630–1647. doi:10.1007/s10646-016-1724-9 [PMC free article] [PubMed]
Henry M, Beguin M, Requier F, et al. A common pesticide decreases foraging success and survival in honey bees. Science. 2012;336:348–350. doi: 10.1126/science.1215039. [PubMed] [CrossRef] [Google Scholar]
Hilton MJ, Jarvis TD, Ricketts DC. The degradation rate of thiamethoxam in European field studies. Pest Manag Sci. 2015;72:388–397. doi: 10.1002/ps.4024. [PubMed] [CrossRef] [Google Scholar]
Hladik ML, Kolpin DW, Kuivila KM. Widespread occurrence of neonicotinoid insecticides in streams in a high corn and soybean producing region, USA. Environ Pollut. 2014;193:189–196. doi: 10.1016/j.envpol.2014.06.033. [PubMed] [CrossRef] [Google Scholar]
Hladik ML, Kolpin DW. First national-scale reconnaissance of neonicotinoid insecticides in streams across the USA. Environ Chem. 2016;13:12–20. doi: 10.1071/EN15061. [CrossRef] [Google Scholar]
Hladik ML, Vandever M, Smalling KL. Exposure of native bees foraging in an agricultural landscape to current-use pesticides. Sci Total Environ. 2016;542:469–477. doi: 10.1016/j.scitotenv.2015.10.077. [PubMed] [CrossRef] [Google Scholar]
Iwasa T, Motoyama N, Ambrose JT, Roe RM. Mechanism for the differential toxicity of neonicotinoid insecticides in the honey bee, Apis mellifera. Crop Prot. 2004;23:371–378. doi: 10.1016/j.cropro.2003.08.018. [CrossRef] [Google Scholar]
Jeschke P, Nauen R, Schindler M, Elbert A. Overview of the status and global strategy for neonicotinoids. J Agric Food Chem. 2011;59:2897–2908. doi: 10.1021/jf101303g. [PubMed] [CrossRef] [Google Scholar]
Jeschke, P., Nauen, R., Schindler, M. & Elbert, A. 2011. Overview of the status and global strategy for neonicotinoids. Journal of Agricultural and Food chemistry, 59: 2887-2908.
Jones A, Harrington P, Turnbull G. Neonicotinoid concentrations in arable soils after seed treatment applications in preceding years. Pest Manag Sci. 2014;70:1780–1784. doi: 10.1002/ps.3836. [PubMed] [CrossRef] [Google Scholar]
Kessler, Sebastien C., Erin Jo Tiedeken, Kerry L. Simcock, Sophie Derveau, Jessica Mitchell, Samantha Softley, Jane C. Stout et Geraldine A. Wright, Bees prefer foods containing neonicotinoid pesticides, Nature 521, 74–76 (07 May 2015)
Kitulagodage M, Astheimer LB, Buttemer WA. Diacetone alcohol, a dispersant solvent, contributes to acute toxicity of a fipronil-based insecticide in a passerine bird. Ecotoxicol Environ Saf. 2008;71:597–600. doi: 10.1016/j.ecoenv.2007.11.001. [PubMed] [CrossRef] [Google Scholar]
Kitulagodage M, Buttemer WA, Astheimer LB. Adverse effects of fipronil on avian reproduction and development: maternal transfer of fipronil to eggs in zebra finch Taeniopygia guttata and in ovoexposure in chickens Gallus domesticus. Ecotoxicology. 2011;20:653–660. doi: 10.1007/s10646-011-0605-5. [PubMed] [CrossRef] [Google Scholar]
Kitulagodage M, Isanhart J, Buttemer WA, Hooper MJ, Astheimer LB. Fipronil toxicity in northern bobwhite quail Colinus virginianus: reduced feeding behaviour and sulfone metabolite formation. Chemosphere. 2011;83:524–530. doi: 10.1016/j.chemosphere.2010.12.057. [PubMed] [CrossRef] [Google Scholar]
Klee J, Besana AM, Genersch E, et al. Widespread dispersal of the microsporidian Nosema ceranae, an emergent pathogen of the western honey bee, Apis mellifera. J Insect Pathol. 2007;96:1–10. doi: 10.1016/j.jip.2007.02.014. [PubMed] [CrossRef] [Google Scholar]
Krupke CH, Hunt GJ, Eitzer BD, Andino G, Given K. Multiple route of pesticide exposure for honeybees living near agricultural fields. PLoS One. 2012;7:e299268. doi: 10.1371/journal.pone.0029268. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Krupke, C.H., Hunt, G.J., Zitzer; B.D., Andino,G. & Given, K., 2012. Multiple routes of pesticide exposure for honey bees living near agriculturela fields. PLoS ONE 7(1): e29268. Doi: 10. 10.1371/Journal.pone.0029268.
Kunce W, Josefsson S, Örberg J, Johansson F. Combination effects of pyrethroids and neonicotinoids on development and survival of Chironomus riparius. Ecotoxicol Environ Saf. 2015;122:426–431. doi: 10.1016/j.ecoenv.2015.09.008. [PubMed] [CrossRef] [Google Scholar]
Laycock I, Cotterell K, O’Shea-Wheller TA, Cresswell JE. Effects of the neonicotinoid pesticide thiamethoxam at field-realistic levels on microcolonies of Bombus terrestris worker bumblebees. Ecotoxicol Environ Saf. 2014;100:153–158. doi: 10.1016/j.ecoenv.2013.10.027. [PubMed] [CrossRef] [Google Scholar]
Limay-Rios V, Forero G, Xue Y, Smith J, Baute T, Schaafsma A. Neonicotinoid insecticide residues in soil dust and associated parent soil in fields with a history of seed treatment use on crops in southwestern Ontario. Environ Toxicol Chem. 2015;35:303–310. doi: 10.1002/etc.3257. [PubMed] [CrossRef] [Google Scholar]
Long EY, Krupke CH. Intersections between neonicotinoid seed treatments and honey bees. Curr Opin Insect Sci. 2015;10:8–13. doi: 10.1016/j.cois.2015.04.005. [PubMed] [CrossRef] [Google Scholar]
Long EY, Krupke CH. Non-cultivated plants present a season-long route of pesticide exposure for honey bees. Nat Commun. 2016;7:11629. doi: 10.1038/ncomms11629. [PMC free article] [PubMed] [CrossRef] [Google Scholar]Lopez-Anita A, Ortiz-Santaliestra ME,
Lopez-Antia A, Ortiz-Santaliestra ME, Mougeot F, Mateo R. Experimental exposure of red-legged partridges (Alectoris rufa) to seeds coated with imidacloprid, thiram anddifenoconazole. Ecotoxicology. 2013;22:125–138. doi: 10.1007/s10646-012-1009-x. [PubMed] [CrossRef] [Google Scholar]
Lu Z, Challis JK, Wong CS. Quantum yields for direct photolysis of neonicotinoids insecticides in water: implications for exposure to nontarget aquatic organisms. Environ Sci Technol. 2015;2:188–192. doi: 10.1021/acs.estlett.5b00136. [CrossRef] [Google Scholar]
Main AR, Headley JV, Peru KM, Michel NL, Cessna AJ, Morrissey CA. Widespread use and frequent detection of neonicotinoid insecticides in wetlands of Canada’s prairie pothole region. PLoS One. 2014;9:e92821. doi: 10.1371/journal.pone.0092821. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Main AR, Michel NL, Cavallaro MC, Headley JV, Peru KM, Morrissey CA. Snowmelt transport of neonicotinoid insecticides to Canadian prairie wetlands. Agric Ecosyst Environ. 2016;215:76–84. doi: 10.1016/j.agee.2015.09.011. [CrossRef] [Google Scholar]
Manzone M, Balsari P, Marucco P, Tamagnone M. Potential external contamination of pneumatic seed drills during sowing of dressed maize seeds. Pest Manag Sci. 2015;72:1302–1308. doi: 10.1002/ps.4148. [PubMed] [CrossRef] [Google Scholar]
Mason R, Tennekes H, Sánchez-Bayo F, Jepsen PU. Immune suppression by neonicotinoid insecticides at the root of global wildlife declines. J Environ Immunol Toxicol. 2014;1:3–12. doi: 10.7178/jeit.1. [CrossRef] [Google Scholar]
Mineau P, Palmer C. Neonicotinoid insecticides and birds: the impact of the nation’s most widely used insecticides on birds. USA: American Bird Conservancy; 2013. [Google Scholar]
Mogren CL, Lundgren JG. Neonicotinoid-contaminated pollinator strips adjacent to cropland reduce honey bee nutritional status. Sci Rep. 2016;6:29608. doi: 10.1038/srep29608. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Mommaerts V, Reynders S, Boulet J, Besard L, Sterk G, Smagghe G. Risk assessment for side-effects of neonicotinoids against bumblebees with and without impairing foraging behaviour. Ecotoxicology. 2010;19:207–215. doi: 10.1007/s10646-009-0406-2. [PubMed] [CrossRef] [Google Scholar]
Morrissey CA, Mineau P, Devries JH, Sánchex-Bayo F, Liess M, Cavallaro MC, Liber K. Neonicotinoid contamination of global surfacewaters and associated risk to aquatic invertebrates: a review. Environ Int. 2015;74:291–303. doi: 10.1016/j.envint.2014.10.024. [PubMed] [CrossRef] [Google Scholar]
Mörtl M, Kereki O, Darvas B, Klátyik S, Vehovszky A, Gyóri J, Székács A. Study on soil mobility of two neonicotinoid insecticides. J Chem. 2016;2016:4546584. doi: 10.1155/2016/4546584. [CrossRef] [Google Scholar]
Mougeot F, Mateo R. Imidacloprid-treated seed ingestion has lethal effect on adult partridges and reduces both breeding investment and offspring immunity. Environ Res. 2015;136:97–107. doi: 10.1016/j.envres.2014.10.023. [PubMed] [CrossRef] [Google Scholar]
Nieto A, Roberts SPM, Kemp J, et al. European red list of bees. Luxembourg: Publication Office of the European Union; 2014. [Google Scholar]
Nuyttens D, Devarrewaere W, Verboven P, Foqué P. Pesticide-laden dust emission and drift from treated seeds during seed drilling: a review. Pest Manag Sci. 2013;69:564–575. doi: 10.1002/ps.3485. [PubMed] [CrossRef] [Google Scholar]
Pecenka JR, Lundgren JG. Non-target effects of clothianidin on monarch butterflies. Sc Nat. 2015;102:19. doi: 10.1007/s00114-015-1270-y. [PubMed] [CrossRef] [Google Scholar]
Peña A, Rodríguez-Liébana JA, Mingorance MD. Persistence of two neonicotinoid insecticides in wastewater, and in aqueous solutions of surfactants and dissolved organic matter. Chemosphere. 2011;84:464–470. doi: 10.1016/j.chemosphere.2011.03.039. [PubMed] [CrossRef] [Google Scholar]
Pesticide properties database (PPDB) (2012) Pesticide properties database. http://sitem.herts.ac.uk/aeru/ppdb/en/index.htm
Pettis J, vanEngelsdorp D, Johnson J, Dively G. Pesticide exposure in honey bees results in increased levels of the gut pathogen Nosema. Naturwissenschaften. 2012;99:153–158. doi: 10.1007/s00114-011-0881-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Pilling E, Campbell P, Coulson M, Ruddle N, Tornier I. A four-year field program investigating long-term effects of repeated exposure of honey bee colonies to flowering crops treated with thiamethoxam. PLoS One. 2013;8:e77193. doi: 10.1371/journal.pone.0077193. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Pisa L.W. et al., 2014. Effets des néonocotinoïdes et du fipronil sur les invertébrés. Environmental Science and Pollution Research, 2015: 68-102.
Pisa LW, Amaral-Rogers V, Belzunces LP, et al. Effects of neonicotinoids and fipronil on non-target invertebrates. Environ Sci Pollut Res. 2015;22:68–102. doi: 10.1007/s11356-014-3471-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Pistorius J, Bischoff G, Heimbach U, Stähler M (2009) Bee poisoning incidents in Germany in spring 2008 caused by abrasion of active substance from treated seeds during sowing of maize. In: Proceedings “Hazards of pesticides to bees—10th international symposium of the ICP-bee protection group”. Julius-Kühn Archiv 423:118–126
Placke FJ (1998a) Long-term soil dissipation study with Confidor 70WG in apple orchards in Germany following spray application. Draft assessment report (DAR)—public version—initial risk assessment provided by the rapporteur member state Germany for the existing active substance imidacloprid. Vol 3, annex B, B8. European Food Safety Authority, Parma, pp 630–637
Placke FJ (1998b) Long-term soil dissipation study with Zelmone 350 FS in great Britain following deed dressing of winter barley. Draft assessment report (DAR)—public version—initial risk assessment provided by the rapporteur member state Germany for the existing active substance imidacloprid. Vol 3, annex B, B8 European Food Safety Authority, Parma, pp 637–642
Pohorecka K, Skubida P, Semkiw P, et al. Effects of exposure of honey bee colonies to neonicotinoid seed-treated maize crops. J Agric Sci. 2013;57:199–208. [Google Scholar]
Qi W, Singer H, Berg M, Müller B, Pernet-Coudrier B, Liu H, Qu J. Elimination of polar micropollutants and anthropogenic markers by wastewater treatment in Beijing, China. Chemosphere. 2015;119:1054–1061. doi: 10.1016/j.chemosphere.2014.09.027. [PubMed] [CrossRef] [Google Scholar]
Reetz JE, Schulz W, Seitz W, Spiteller M, Zühlke S, Armbruster W, Wallner K. Uptake of neonicotinoid insecticides by water foraging honey bees (Hymenoptera: Apidae) through guttation fluid of winter oilseed rape. J Econ Entomol. 2015;109:31–40. doi: 10.1093/jee/tov287. [PubMed] [CrossRef] [Google Scholar]
RIVM . In: Environmental risk limits for imidacloprid. Posthuma-Doodeman CJAM, editor. Netherlands: National Institute for Public Health and the Environment Bilthoven; 2008. [Google Scholar]
RIVM (2014) Water quality standards for imidacloprid: proposal for an update according to the water framework directive. In: Smit CE (ed) National institute for public health and the environment. Bilthoven, Netherlands
Rolke D, Persigehl M, Peters B, Sterk G, Blenau W. Large-scale monitoring of effects of clothianidin-dressed oilseed rape seeds on pollinating insects in northern Germany: residues of clothianidin in pollen, nectar and honey. Ecotoxicology. 2016;25:1691. doi: 10.1007/s10646-016-1723-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Rundlof et al. 2015 Seed coating with a neonicotinoid insecticide negatively affects wild bees. Nature 521: 77-80
Rundlöf M, Andersson GKS, Bommarco R, et al. Seed coating with a neonicotinoid insecticide negatively affects wild bees. Nature. 2015;521:77–80. doi: 10.1038/nature14420. [PubMed] [CrossRef] [Google Scholar]
Rundlöf Maj, Georg K. S. Andersson, Riccardo Bommarco, Ingemar Fries, Veronica Hederström, Lina Herbertsson, Ove Jonsson, Björn K. Klatt, Thorsten R. Pedersen, Johanna Yourstone et Henrik G. Smith, Seed coating with a neonicotinoid insecticide negatively affects wild bees, Nature 521, 77–80 (07 May 2015)
Sadaria AM, Supowit SD, Halden RU. Mass balance assessment for six neonicotinoid insecticides during conventional wastewater and wetland treatment: nationwide reconnaissance in United States wastewater. Sci Total Environ. 2016;50:6199–6206. doi: 10.1021/acs.est.6b01032. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Samson-Robert O, Labrie G, Chagnon M, Fournier V. Neonicotinoid-contaminated puddles of water represent a risk of intoxication for honeybees. PLoS One. 2014;9:e108443. doi: 10.1371/journal.pone.0108443. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Samson-Robert, O. Traitement des semences néocotinoïdes : impacts sur les abeilles, les bourdons et la contanimation de l’eau
Sánchex-Bayo F, Goka K. Pesticide residues and bees—a risk assessment. PLoS One. 2014;9:e94482. doi: 10.1371/journal.pone.0094482. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Sánchez-Bayo F, Goulson D, Pennacchio F, Nazzi F, Goka K, Desneux N. Are bee diseases linked to pesticides? A brief review. Environ Int. 2016;89-90:7–11. doi: 10.1016/j.envint.2016.01.009. [PubMed] [CrossRef] [Google Scholar]
Sánchez-Bayo F, Hyne RV. Detection and analysis of neonicotinoids in river waters—development of a passive sampler for three commonly used insecticides. Chemosphere. 2014;99:143–151. doi: 10.1016/j.chemosphere.2013.10.051. [PubMed] [CrossRef] [Google Scholar]
Sánchez-Bayo F. Comparative acute toxicity of organic pollutants and reference values for crustaceans. I. Branchiopoda, Copepoda and Ostracoda. Environ Pollut. 2006;139:385–420. doi: 10.1016/j.envpol.2005.06.016. [PubMed] [CrossRef] [Google Scholar]
Sandrock C, Tanadini LG, Pettis JS, Biesmeijer JC, Potts SG, Neumann P. Sublethal neonicotinoid insecticide exposure reduces solitary bee reproductive success. Agric For Entomol. 2014;16:119–128. doi: 10.1111/afe.12041. [CrossRef] [Google Scholar]
Santos A, Oliveira BL, Samuels RI. Selection of entomopathogenic fungi for use in combination with sublethal doses of Imidacloprid. Mycopathology. 2007;163:233–240. doi: 10.1007/s11046-007-9009-8. [PubMed] [CrossRef] [Google Scholar]
Schaafsma A, Limay-Rios V, Baute T, Smith J, Xue Y. Neonicotinoid insecticide residues in surface water and soil associated with commercial maize (corn) fields in southwestern Ontario. PLoS One. 2015;10:e0118139. doi: 10.1371/journal.pone.0118139. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Schaafsma A, Limay-Rios V, Xue Y, Smith J, Baute T. Field-scale examination of neonicotinoid insecticide persistence in soils as a result of seed treatment use in commercial maize (corn) fields in southerwestern Ontario. Environ Toxicol Chem. 2016;35:295–302. doi: 10.1002/etc.3231. [PubMed] [CrossRef] [Google Scholar]
Scholer J, Krischik V. Chronic exposure of imidacloprid and clothianidin reduce queen survival, foraging, and nectar storing in colonies of Bombus impatiens. PLoS One. 2014;9:e91573. doi: 10.1371/journal.pone.0091573. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Selim HM, Jeong CY, Elbana TA. Transport of imidacloprid in soils: miscible displacement experiments. Soil Sci. 2010;175:375–381. doi: 10.1097/SS.0b013e3181ebc9a2. [CrossRef] [Google Scholar]
Sgolastra F, Medrzycki P, Bortolotti L et al (2016) Synergistic mortality between a neonicotinoid insecticide and an ergosterol-biosynthesis-inhibiting fungicide in three bee species. Pest Manag Sci 73:1236–1243 [PubMed]
Simon-Delso N, Amaral-Rogers V, Belzunces LP, et al. Systemic insecticides (neonicotinoids and fipronil): trends, uses, mode of action and metabolites. Environ Sci Pollut Res. 2015;22:5–34. doi: 10.1007/s11356-014-3470-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Simon-Deslo, H. et al., 2013. Systemic insecticides (neocorinoids and fipronil): trends, uses, mode of action and metabolites. Environmental Science and Pollution Research, 22 (1): 5-34.
Smalling KL, Reeves R, Muths E, Vandever M, Battaglin WA, Hladik ML, Pierce CL. Pesticide concentrations in frog tissue and wetland habitats in a landscape dominated by agriculture. Sci Total Environ. 2015;502:80–90. doi: 10.1016/j.scitotenv.2014.08.114. [PubMed] [CrossRef] [Google Scholar]
Smit CE, Posthuma-Doodeman CJAM, Van Vlaardingen PLA, De Jong FMW (2014) Ecotoxicity of imidacloprid to aquatic organisms: derivation of water quality standards for peak and long-term exposure. Hum Ecol Risk Assess. doi:10.1080/10807039.2014.964071
Spurgeon D, Hesketh H, Lahive E et al (2016) Chronic oral lethal and sublethal toxicities of different binary mixtures of pesticides and contaminants in bees (Apis mellifera, Osmia bicornis and Bombus terrestris). EFSA supporting publication 2016:EN-1076. Centre for Ecology and Hydrology, Wallingford
Stanley DA, Garratt MPD, Wickens JB, Wickens VJ, Potts SG, Raine NE. Neonicotinoid pesticide exposure impairs crop pollination services provided by bumblebees. Nature. 2015;528:548–550. doi: 10.1038/nature16167. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Stanley DA, Raine NE. Chronic exposure to a neonicotinoid pesticide alters the interactions between bumblebees and wild plants. Funct Ecol. 2016;30:1132–1139. doi: 10.1111/1365-2435.12644. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Sterk G, Peters B, Gao Z, Zumkier U. Large-scale monitoring of effects of clothianidin-dressed OSR seeds on pollinating insects in northern Germany: effects on large earth bumble bees (Bombus terrestris) Ecotoxicology. 2016;25:1666–1678. doi: 10.1007/s10646-016-1730-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Stewart SD, Lorenz GM, Catchot AL, et al. Potential exposure of pollinators to neonicotinoid insecticides from the use of insecticide seed treatments in the mid-southern United States. Environ Sci Technol. 2014;48(9762):9769. [PubMed] [Google Scholar]
Sur R, Stork A. Uptake, translocation and metabolism of imidacloprid in plants. Bull Insectol. 2003;56:35–40. [Google Scholar]
Switzer CM, Combes SA. The neonicotinoid pesticide, imidacloprid, affects Bombus impatiens (bumblebee) sonication behavior when consumed at doses below the LD50. Ecotoxicology. 2016;25:1150–1159. doi: 10.1007/s10646-016-1669-z. [PubMed] [CrossRef] [Google Scholar]
Syracuse Environmental Research Associate (SERA) (2005) Imidacloprid—human health and ecological risk assessment—final report. Report from Syracuse environmental research associates to USDA, Forest Service, Manlius, New York
Szczepaniec A, Creary SF, Laskowski KL, Nyrop JP, Raupp MJ. Neonicotinoid insecticide imidacloprid causes outbreaks of spider mites on elm trees in urban landscapes. PLoS One. 2011;6:e20018. doi: 10.1371/journal.pone.0020018. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Székács A, Mörtl M, Darvas B. Monitoring pesticide residues in surface and ground water in Hungary: surveys in 1990–2015. J Chem. 2015;2015:717948. doi: 10.1155/2015/717948. [CrossRef] [Google Scholar]
Thompson HM, Fryday SL, Harkin S, Milner S. Potential impacts of synergism in honeybees (Apis mellifera) of exposure to neonicotinoids and sprayed fungicides in crops. Apidologie. 2014;45:545–553. doi: 10.1007/s13592-014-0273-6. [CrossRef] [Google Scholar]
Thuyet DQ, Watanabe H, Motobayashi T. Effect of formulations and treatment methods of nursery boxes applied with insecticide on the behavior of imidacloprid in rice paddy fields. J Pest Sci. 2011;36:9–15. doi: 10.1584/jpestics.G10-49. [CrossRef] [Google Scholar]
Tingle CCD, Rother JA, Dewhurst CF, Lauer S, King WJ. Fipronil: environmental fate, ecotoxicology and human health concerns. Rev Environ Contam Toxicol. 2003;176:1–66. [PubMed] [Google Scholar]
Tišler T, Jemec A, Mozetic B, Trebse P. Hazard identification of imidacloprid to aquatic environment. Chemosphere. 2009;76:907–914. doi: 10.1016/j.chemosphere.2009.05.002. [PubMed] [CrossRef] [Google Scholar]
Tokumoto J, Danjo M, Kobayashi Y, et al. Effects of exposure to clothianidin on the reproductive system of male quails. J Vet Med Sci. 2013;75:755–760. doi: 10.1292/jvms.12-0544. [PubMed] [CrossRef] [Google Scholar]
U.S. EPA . Guidance for assessing pesticide risks to bees. USA: Washington D.C; 2014. [Google Scholar]
U.S. EPA (2012) United States Environmental Protection Agency Ecological Risk Assessment. http://www.epa.gov/oppefed1/ecorisk_ders/toera_analysis_eco.htm
U.S. EPA (2014a) OPP Pesticide Toxicity Database. http://www.epa.gov/oppefed1/ecorisk_ders/aquatic_life_benchmark.htm
Van des Sluijs, J.PP, Simon-Delso, N. ; Goulson, D., Maxim, L., Bonmatin, J.M. & Belzunces, L.P. 2013. Neocotinoids, bee disorder a,d the sustainability of pollinator services. Current Opinion in Environmental Sustainibility, 6: 293-305.
Van Dijk TC, Van Staalduinen MA, Van der Sluijs JP. Macro-invertebrate decline in surface water polluted with imidacloprid. PLoS One. 2013;8:e62374. doi: 10.1371/journal.pone.0062374. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
vanEngelsdorp D, Speybroeck N, Evans JD, et al. Weighing risk factors associated with bee Colony collapse disorder by classification and regression tree analysis. J Econ Entomol. 2010;103:1517–1523. doi: 10.1603/EC09429. [PubMed] [CrossRef] [Google Scholar]
Vidau C, Diogon M, Aufauvre J, et al. Exposure to sublethal doses of fipronil and thiacloprid highly increases mortality of honeybees previously infected by Nosema ceranae. PLoS One. 2011;6:e21550. doi: 10.1371/journal.pone.0021550. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Vijver MG, van den Brink J. Macro-invertebrate decline in surface water polluted with imidacloprid: a rebuttal and some new analyses. PLoS One. 2014;9:e89837. doi: 10.1371/journal.pone.0089837. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
von Gunten K (2012) Photodegradation and sorption to Na-SAz clay, soil and pollen of the neonicotinoids acetamiprid, clothianidin, imidacloprid and thiacloprid. https://www.yumpu.com/en/document/view/7393414/photodegradation-and-sorption-to-na-sazclay-soil-eth-zurichWachendorff-Neumann U, Mauler-Machnik A, Erdelen C, Ohtake H (2012) Synergistic mixture of trifloxystrobin and imidacloprid. Google patents. United States: Bayer Cropscience AG
Wang L, Zeng L, Chen J. Impact of imidacloprid on new queens of imported fire ants, Solenopsis invicta (Hymenoptera: Formicidae) Sci Rep. 2015;5:17938. doi: 10.1038/srep17938. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Wang L, Zeng L, Chen J. Sublethal effect of imidacloprid on Solenopsis invicta (Hymenoptera: Formicidae) feeding, digging, and foraging behaviour. Environ Entomol. 2015;44:1544–1552. doi: 10.1093/ee/nvv127. [PubMed] [CrossRef] [Google Scholar]
Wang Y, Wu S, Chen L, Wu C, Yu R, Wang Q, Zhao X. Toxicity assessment of 45 pesticides to the epigeic earthworm Eisenia fetida. Chemosphere. 2012;88:484–491. doi: 10.1016/j.chemosphere.2012.02.086. [PubMed] [CrossRef] [Google Scholar]
Whitehorn PR, O’Connor S, Wackers FL, Goulson D. Neonicotinoid pesticide reduces bumble bee colony growth and queen production. Science. 2012;336:351–352. doi: 10.1126/science.1215025. [PubMed] [CrossRef] [Google Scholar]
Whitehorn PR, O’Connor, S., Wackers, F. L. & Goulson, D. 2012. Neonicotinoid pesticide reduces bumble bee colony growth and queen production. Science, 336, 351-352
Wood Thomas James & Goulson Dave. 2017.The environmental risks of neonicotinoid pesticides: a review of the evidence. Environmental Science and Pollution Research, 24(1): 17285-17325.
Woodcock BA, Isaac NJB, Bullock JM, Roy DB, Garthwaite DG, Crowe A, Pywell RF. Impacts of neonicotinoid use on long-term population changes in wild bees in England. Nat Commun. 2016;7:12459. doi: 10.1038/ncomms12459. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Xing ZS, Chow L, Rees H, Meng FR, Li S, Ernst B, Benoy G, Zha TS, Hewitt LM. Influences of sampling methodologies on pesticide-residue detection in stream water. Arch Environ Contam Toxicol. 2013;64:208–218. doi: 10.1007/s00244-012-9833-9. [PubMed] [CrossRef] [Google Scholar]
Xu T, Dyer DG, McConnell LL, Bondarenko S, Allen R, Heinemann O. Clothianidin in agricultural soils and uptake into corn pollen and canola nectar after multiyear seed treatment applications. Environ Toxicol Chem. 2016;35:311–321. doi: 10.1002/etc.3281. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Yu RX, Wang YH, Hu XQ, Wu SG, Cai LM, Zhao XP. Individual and joint acute toxicities of selected insecticides against Bombyx mori (Lepidoptera: Bombycidae) J Econ Entomol. 2015;109:327–333. doi: 10.1093/jee/tov316. [PubMed] [CrossRef] [Google Scholar]
Bravo pour votre copier/coller qui démontre une excellente maitrise des outils de recherche bibliographique, un peu moins de celle de la compréhension des articles cités (vous y avez inclus les rapports de la Commission Européenne et les évaluations de l’EFSA qui ont conclu à l’autorisation des néonicotinoïdes.
Malheureusement, c’est un peu hors-sujet par rapport au contenu de mon article, qui indiquait dès le début qu’il ne portait que sur deux articles, qui sont les deux seuls qui parlent d’une décroissance aussi importante des populations d’insectes.
Ce post est un exemple particulièrement réjouissant du classique « mille-feuilles argumentatif », qui cherche à détourner les critiques argumentées contre une publication précise, en citant une foule de publications qui n’ont rien à voir. La publication de Sanchez-Bayo, que vous citez dans votre commentaire suivant, est un bon exemple.
De nombreux articles paraissent sur la décroissance des abeilles, mais les statistiques de production de miel au niveau mondial montent une augmentation lente… Curieux, non…
Cher Monsieur,
J’ai trouvé votre article très intéressant. Il se situe en droite ligne des stratégies utilisées par les négationnistes de l’effet de la nicotine ou du changement climatique. (1) Négation des faits: trop compliqué, mesures non significatives, complexité, artefacts dus à d’autres causes. (2) Négation des impacts, attribution de la recherches majoritaires à un complot scientifique : c’est dans l’air du temps, on préfère un avis iconoclaste à plusieurs milliers d’avis concordants. (3) Mise en place d’une expérimentation « pro domo », avec des résultats qui contredisent la majorité des études scientifiques. (4) Financer – ouvertement ou plus discrètement – des rapports ou des articles scientifiques, écrits par des scientifiques ayant des liens avec les industriels. Tout cela mis en musique par un lobbying efficace envers le public et les élus.
.
Je comprends votre situation et je ne vous jette pas la pierre. Vous êtes payé pour cela. Reprenons vos arguments. Vous disséquez un article de revue. Mais ce n’est pas « un » article qu’il faudrait revoir, mais des centaines, des milliers. Je vous fait confiance dans votre critique, bien que les erreurs me paraissent très « grosses »: prendre le pois frais et non le poids sec pour mesurer une biodiversité ! Pourquoi pas. Vous citez la boulette de The Lancet pour mettre en doute l’ensemble de la science (ah, une tactique que j’ai oubliée chez les négationnistes : (5) semer le doute sur des milliers d’articles, en débusquant « une » erreur dans l’un de ces articles). Toutefois, pour la critique de cet article scientifique, je l’interroge sur votre compétence, vous dont le CV montre 3 « articles » depuis 2016, dont une dans un symposium et deux pour des posters. Toutes trois sans contrôle indépendant, bien sûr.
Vous n’êtes par le premier à critiquer le travail de Gaspar A. Hallmann & al. de 2007. D’autres l’ont fait. Peut-être de façon un peu plus subtile: Sanchez Bayo & al. en 2009 dans Biological Conservation. Mais en admettant dans leur article 75% de perte de la diversité des Insectes en 27 années: 49% pour la destruction des habitats, 25,8% pour la pollution (pesticides agricoles, 17,6% pour des facteurs environnementaux divers. Cela montre que le problème est complexe, mais ne dédouane pas l’agriculture – et non les agriculteurs – de sa responsabilité. Un autre article, celui de Thomas Jones et Hartley de 2019, dans Global Change Biology juge l’article de Hallmann effectivement trop à charge. Mais ils reconnaissent que l’agriculture est responsable de 80% de la déforestation et que les pesticides font chuter les populations d’insectes mais ils ajoutent que ne plus les utiliser augmenterait de 70% les pertes agricoles. J’en suis d’accord.
Mais, de nos jours, la question de la balance entre les besoins alimentaires humains et la perte des espèces, est devenue inaudible. Peut-être pouvez-vous comprendre cela ?
Michel Lepage
Un dernier point caractéristique de votre attitude : il vous parait un peu « gros » que Hallmann et al aient pu faire une « boulette » aussi énorme que de calculer des biomasses fraiches, et non sèches. C’est pourtant écrit en toutes lettres, sans aucune ambiguïté possible, dans leur article. C’est comme dans le commentaire de Mathieu Schopfer ci-dessus, qui présentait comme une absurdité de ma part de modéliser une décroissance par un modèle linéaire, alors que c’est bien ce qu’on fait Seibold et al.
Dans les deux cas, vos commentaires montrent que vous n’avez même pas fait l’effort de lire les articles étudiés, pour vérifier si ce que je disais est vrai ou non. Encore mieux, vous essayez de m’attribuer leurs absurdités scientifiques. Si vous considérez qu’utiliser des biomasses fraiches est une mauvaise méthode, allez troller Hallmann et non moi. ça vous permettra aussi de constater, dans les commentaires de son article, que je suis loin d’être le seul à contester ses méthodes.
Comme votre commentaire précédent, c’est un exemple parfait d’une autre méthode classique des pseudoscientifiques, pour éviter de répondre à toute critique : le déshonneur par association. Plutôt que de répondre à des objections factuelles, mieux vaut discréditer le contradicteur en lui prêtant des conflits d’intérêt qui dispensent d’étudier ce qu’il dit.
Désolé de vous décevoir, je n’ai pas été payé pour cet article. Vous êtes libre de ne pas me croire, mais par contre c’est à vous d’expliquer pourquoi vous parlez d’une « expérimentation pro domo » qui contredirait le consensus scientifique. Les seuls articles qui contredisent le consensus scientifique ne sont pas de moi : ce sont ceux de Hallmann et de Seibold, dont je montre dans mon article les acrobaties méthodologiques, avec leurs 75% de décroissance de biomasse ou de ombre d’individus, donc d’abondance en terme écologique. Dans l’article de Sanchez-Bayo que vous citez, les chiffres portent sur le % d’espèces qui sont en diminution, et non sur la baisse d’abondance de ces espèces. Or ces deux mesures n’ont rien à voir. Imaginons que la surface de la terre habitable par les insectes diminue de 10%, sans aucune modification de la densité de population des insectes dans les lieux habitables : pour les variables mesurées par Hallmann et Seibold, cela entraine une diminution de 10% au niveau global. Pour les chiffres cités par Sanchez-Bayo, cela veut dire que 100% des espèces sont en déclin.
Autre grand classique pour esquiver les critiques : attaquer le contradicteur en lui prêtant des généralisations qu’il n’a pas faites. Je n’ai dit nulle part que l’agriculture n’avait aucun effet sur la décroissance des populations d’insectes. Je dis qu’à l’heure actuelle, il est difficile de quantifier les rôles respectifs de la simplification des paysages agricoles, et des pesticides. C’est tout l’objet des débats scientifiques sur le land sharing et le land sparing, dont je rappelle tout de même qu’ils penchent plutôt en faveur du land sparing (c’est-à-dire que pour préserver la biodiversité, au moins dans le contexte européen, il serait préférable de maintenir une agriculture intensive sur des surfaces restreintes, en gérant au moins la diversité des paysages naturels non productifs pour l’agriculture).
C’est pour cela que je suis surpris de vous voir écrire que « la question de la balance entre les besoins alimentaires humains et la perte des espèces est devenue inaudible », alors que j’avais plutôt l’impression que c’était un sujet brûlant en ce moment (voir les crises d’urticaire de l’Institut Technique de l’Agriculture Biologique, à propos justement du land sparing).
Lol, votre article est-il passé devant un comité de lecture? celui d’une grande revue scientifique? ah non, c’est du scientisme….
Cet article n’a aucune vocation à paraitre dans une revue à comité de lecture, puisqu’il ne s’agit pas de travaux originaux mais d’une lecture critique de deux publications originales.
Par contre, vous pourrez constater par vous-même que j’ai bien publié ces critiques dans les commentaires de l’article de Hallmann et al dans Plos ONE (où je n’étais d’ailleurs pas le premier à souligner le caractère très douteux de leurs données), et que les auteurs n’ont en rien cherché à y répondre. Sans doute sont -ils de trop grands scientifiques pour s’abaisser à défendre leur point de vue…
https://journals.plos.org/plosone/article/comment?id=10.1371/annotation/461e660c-4307-4ed7-b522-2697700e88eb